BCM-514
Biochimie des protéines
2.0 Structure des protéines
2.2 Structure secondaire
La chaîne polypeptidique adopte plusieurs types de structures régulières, mais il n'en existe qu'un petit nombre qu'on retrouve souvent (on pourrait dire que ce sont des modèles éprouvés par la nature).
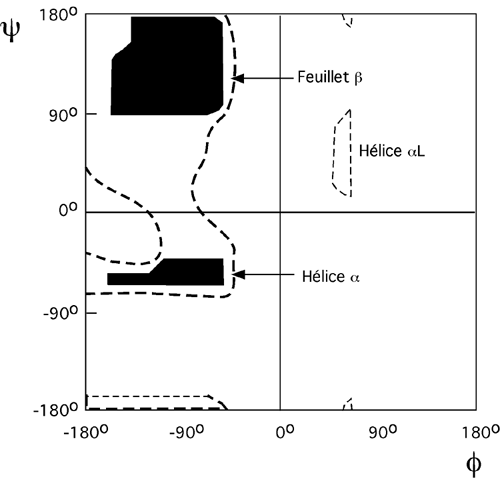
Le biologiste G.N. Ramachandran, qui découvrit entre autres la structure en triple hélice du collagène, se rendit compte en travaillant avec des modèles de polypeptides que certains angles ψ et φ ne pouvaient pas être combinés parce que certains groupements chimiques se rentraient carrément dedans. Son graphique (le graphique de Ramachandran, ci-dessous), nous permet de voir d'un seul coup d'oeil quelles sont les combinaisons toujours permises (en noir) et celles qui sont non-favorisées mais possiblement tolérées (en pointillés). Ces derniers angles assument que les atomes du polypeptide, qui ne sont pas réellement des sphères solides, peuvent voir leurs rayons de contact se superposer légèrement. Les structures secondaires les plus souvent retrouvées dans les protéines sont l'hélice alpha et le feuillet beta; on voit ci-bas quelles combinaisons d'angles peuvent y conduire.
Notez que le graphique de Ramachandran prédit qu'on puisse former une hélice alpha qui tourne à gauche si elle n'est composée que de glycines (angles ψ de 45o et φ de 60o, par exemple). C'est une exception: les hélices alpha tournent presque toujours dans le sens de la main droite.
|
|
2.2.1 L'hélice alpha
Une hélice alpha résulte de la succession d'angles φ de -57o et d'angles ψ de -47o. Cette hélice est droitière; c'est à dire que si vous la saisissiez dans votre main droite, elle tournerait dans le sens de vos doigts en montant dans la direction du pouce (comme la double hélice de l'ADN, soit dit en passant). Notez que ceci reste vrai même si vous la tenez à l'envers, puisqu'une main droite ne devient pas une main gauche juste parce qu'elle est tournée vers le bas.
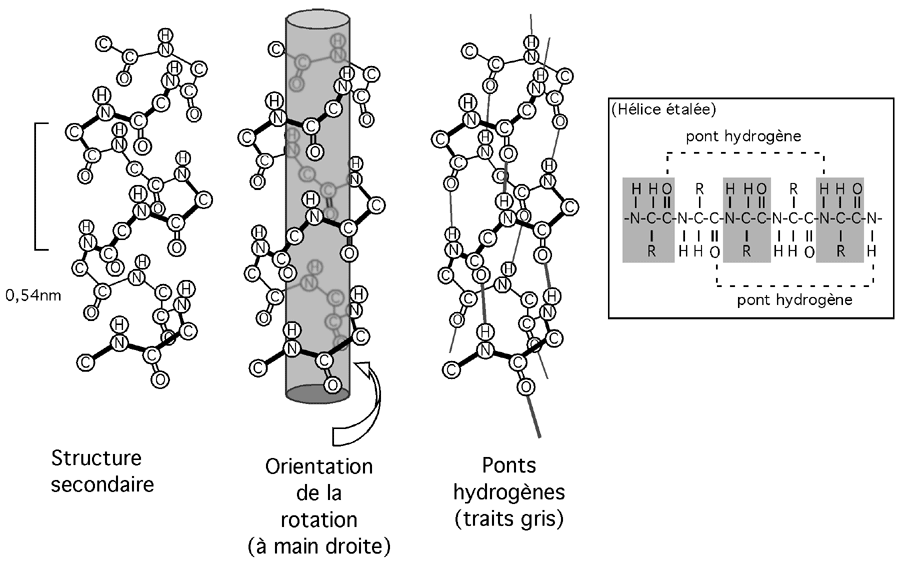
L'hélice alpha s'élève de 0,15 nm par résidu et de 0,54nm à chaque tour. Elle compte 3,6 résidus par tour.
Elle est stabilisée dans sa forme hélicale par des ponts hydrogènes établis entre l'hydrogène d'un groupement aminé -NH et l'oxygène d'un groupement carboxylique -C=O et situé quatre résidus plus loin.
Comme ces ponts hydrogènes vont dans la même direction que l'hélice, celle-ci est élastique: les ponts hydrogènes brisés lors de l'étirement de l'hélice se reformeront facilement quand la tension sera relâchée.
Les chaînes latérales des résidus dans une hélice alpha pointent à l'extérieur de la structure.
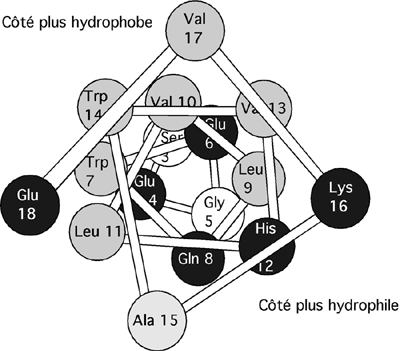
Une telle hélice peut facilement avoir une nature amphipathique si les chaînes latérales se trouvant toutes du même côté ont une nature hydrophile et que celle se trouvant de l'autre côté ont une nature hydrophobe. Le domaine d'interaction protéine-protéine riche en leucine de la structure bZip (aussi appelée "leucine zipper") de plusieurs facteurs de transcription de type AP-1 est une telle hélice amphipathique.
|
Vue plongeante d'une hélice alpha amphipathique. Les résidus chargés ou polaires sont en noir, les résidus hydrophobiques en gris et les petits résidus en blanc. Même si la structure primaire ne révèlerait pas de région particulièrement hydrophile ou hydrophobe, cette vue de l'hélice nous montre qu'une de ses faces est plus hydrophile et l'autre face plus hydrophobe.
|
Les domaines transmembranaires sont souvent constitués d'une ou de plusieurs hélices alpha d'une vingtaine de résidus pour la plupart hydrophobes. La bactériorhodopsine, par exemple, compte sept hélices alpha qui traversent la membrane cellulaire. Ces hélices forment un pore (à la manière d'un beigne qui serait inséré dans la membrane) par lequel les protons peuvent passer. La bactériorhodopsine est une pompe à protons activée par la lumière.
La proline n'ayant pas d'hydrogène sur son goupe aminé, elle ne peut pas contribuer au pontage hydrogène. La proline déstabilise donc l'hélice alpha, et il est rare qu'on retrouve un résidu proline dans une telle hélice. (La proline se retrouve cependant dans un autre type d'hélice, l'hélice de collagène, dont nous parlerons plus tard).
2.2.1.1 L'hélice 310
L'hélice 310 ressemble à une hélice alpha tricotée serré. Elle compte 3 résidus par tour (au lieu de 3,6) et s'élève de 0,6nm pour faire un tour complet au lieu de 0,54nm. Chaque pont hydrogène ferme une boucle de dix atomes, d'où le nom de 310 (3 résidus par tour, 10 atomes dans la boucle).
Dans une hélice 310, les ponts hydrogènes se font entre le groupement -NH en position x et le groupement -C=O en position x+3. (Des ponts hydrogènes entre -NH en x et -C=O en x+5 sont parfois, bien que rarement, observés, dans une structure appelée hélice p).
2.2.2 Le feuillet β
Les feuillets beta (β-sheet en anglais) se forment quand des parties de la longue chaîne polypeptidique se replient et se longent l'une l'autre, côte à côte, en formant des pont hydrogènes avec la voisine. On parle de feuillets beta parallèles quand les chaînes vont dans le même sens et d'antiparallèles quand elles vont dans des directions opposées. La direction des angles Φ et Ψ alterne dans un feuillet beta (un positif, l'autre négatif), donnant à la chaîne une allure en zigzag.
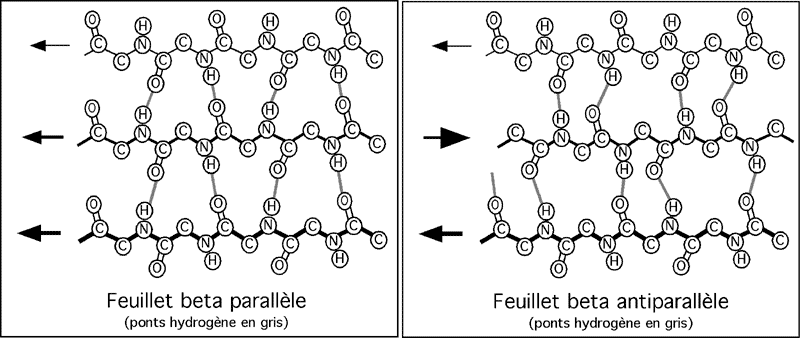
On peut se représenter un feuillet beta comme une grosse croustille Ruffle, avec des chaînes latérales pointant en alternance en haut et en bas. La distance entre deux résidus est de 0,335nm; chaque chaîne est séparée de sa voisine de 0,465nm. Un feuillet beta est représenté, dans les modèles structuraux, par une grosse flèche plate qui indique sa direction.
Puisque les ponts hydrogènes des feuillets beta pointent perpendiculairement à l'axe de la chaîne polypeptidique, ils ne donnent pas d'élasticité à la structure.
On retrouve beaucoup de feuillets beta dans la soie de ver (Bombyx mori) et la toile d'araignée.
Les feuillets beta sont représentés par des flèches, l'hélice alpha est représentée par une spirale.
2.2.3 Hélice vs feuillet
|
résidu
|
fréquence dans une hélice α (1=distribution aléatoire)
|
résidu
|
fréquence dans un feuillet β (1=distribution aléatoire)
|
|
E
|
1,59
|
V
|
1,87
|
|
A
|
1,41
|
I
|
1,67
|
|
L
|
1,34
|
Y
|
1,45
|
|
M
|
1,3
|
C
|
1,40
|
|
Q
|
1,27
|
W
|
1,35
|
|
K
|
1,23
|
F
|
1,33
|
|
R
|
1,21
|
L
|
1,22
|
|
F
|
1,16
|
T
|
1,17
|
|
I
|
1,09
|
M
|
1,14
|
|
H
|
1,05
|
Q
|
0,98
|
|
W
|
1,02
|
S
|
0,96
|
|
D
|
0,99
|
R
|
0,84
|
|
V
|
0,90
|
H
|
0,80
|
|
T
|
0,76
|
A
|
0,72
|
|
N
|
0,76
|
K
|
0,69
|
|
Y
|
0,74
|
G
|
0,58
|
|
C
|
0,66
|
E
|
0,52
|
|
S
|
0,57
|
N
|
0,48
|
|
G
|
0,43
|
D
|
0,39
|
|
P
|
0,34
|
P
|
0,31
|
Certains acides aminés ont une préférence marquée pour certaines structures: expérimentalement, on remarque qu'ils se retrouvent plus souvent dans une structure que dans une autre. Mais même si les hélices alpha et les feuillets beta sont les structures secondaires les plus courantes, il ne faut pas croire qu'un acide aminé soit nécessairement plus porté vers une hélice quand il n'est pas fréquent dans un feuillet, ou vice-versa (ce n'est pas comme si on parlait d'hydrophobicité).
En fait, si certains résidus comme l'acide glutamique préfèrent clairement les hélices alpha aux feuillets beta, et que la cystéine préfère clairement les feuillets beta aux hélices alpha, il y a des résidus comme la leucine qui se retrouve fréquemment dans les deux structures. Il y en a également d'autres (la proline par exemple) qui se retrouvent rarement et dans l'une et dans l'autre.
Le tableau ci-haut vous indique la fréquence des acides aminés dans différentes structures. Une valeur de 1 indique une distribution aléatoire (ou ce à quoi on s'attendrait si les acides aminés étaient distribués au hasard); une valeur supérieure indique qu'on retrouve l'acide aminé plus souvent que ce que le hasard prédit; une valeur inférieure à 1 indique le contraire.
2.2.4 Autres structures secondaires
Il serait inconvenant de négliger les nombreuses autres structures protéiques qu'on retrouve dans la nature. Il en existe plusieurs autres que les feuillets beta et les hélices alpha, mais elles ne sont pas toutes aussi clairement définies ou aussi bien étudiées. De plus, certaines structures moins universellement connues peuvent se retrouver dans la littérature sous différents noms. Ne vous sentez donc pas embêtés si vous ne pouvez pas nommer toutes les structures possibles et imaginables; si jamais vous avez besoin de vous familiariser avec une structure ésotérique particulière, il existe plusieurs resources sur le web qui pourront vous y aider. Pour le moment, il suffit de réaliser qu'il existe un grand nombre de structures secondaires.
Voici quand même les paramètres structuraux de certaines autres structures secondaires, d'après Lesk, A.M. Introduction to protein architecture, Oxford University Press, New York (2001), p.67 et d'après http://www.cryst.bbk.ac.uk/pps97/assignments/projects/szabo/pphelix.htm
Différentes sources ne s'entendent pas toujours à l'unité près sur certaines valeurs, mais elles restent très similaires.
|
structure
|
φ
|
ψ
|
n (résidus par tour)
|
d (élévation en Å entre deux résidus successifs
|
p (élévation en Å pour un tour complet)
|
|
hélice α (à droite)
|
-57
|
-47
|
3,6
|
1,5
|
5,5
|
|
hélice 310 (à droite)
|
-49
|
-26
|
3
|
2
|
6
|
|
hélice β (à droite ou à gauche)
|
-57
|
-70
|
4,4
|
1,1
|
5
|
|
héline de polyproline PPI (à droite)
|
-75
|
+160
|
3,3
|
1,7
|
5,6
|
|
hélice de polyproline PPII (à gauche)
|
-79 (-75)
|
+149 (+145)
|
-3
|
3,1
|
9,4
|
|
feuillet β parallèle
|
-119
|
+113
|
|
3,2
|
|
|
feuillet β antiparallèle
|
-139
|
+135
|
|
3,4
|
|
2.2.4.1 L'hélice beta
L'hélice β ressemble à un ressort qui aurait une section triangulaire plutôt que circulaire. Elle est composée de feuillets beta qui, au lieu d'être plus ou moins parallèles les uns par rapport aux autres, tournent en rond au lieu d'un axe.
C'est une structure retrouvée, par exemple, dans plusieurs protéines antigel. La figure ci-contre, représentant une hélice β de la protéine antigel de Choristoneura fumiferana, est tirée de GRAETHER SP, KUIPER MJ, GAGNÉ SM, WALKER VK, JIA ZC, SYKES BD & DAVIES PL: b-Helix structure and ice-binding properties of a hyperactive antifreeze protein from an insect Nature 406, 325 - 328 (2000) © Macmillan Publishers Ltd.

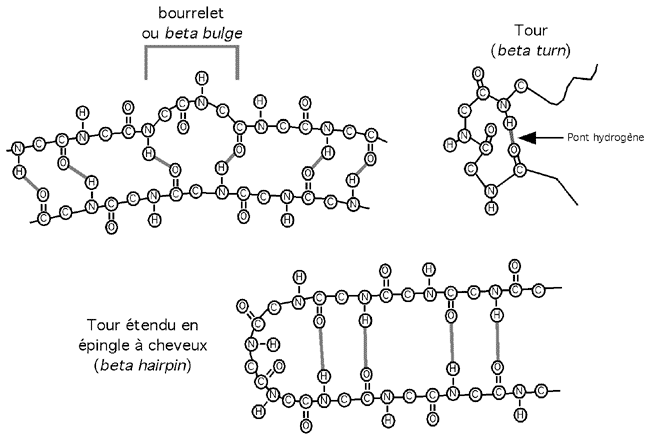
2.2.4.2 Bourrelet β, tour β, et épingle à cheveux β
Ces termes traduisent les noms plus usuels de β-bulge, β-turn et β-hairpin. Le bourrelet β est une discontinuité locale dans la structure d'un feuillet β. Le tour β, lui, est comme un U-turn subit de la chaîne principale de la protéine; on en retrouve souvent à la jonction de deux segments de la chaîne formant un feuillet β antiparallèle. L'épingle à cheveux consiste également en un repli sur elle-même de la chaîne mais est plus étendue.
2.2.4.3 Hélices de proline
|
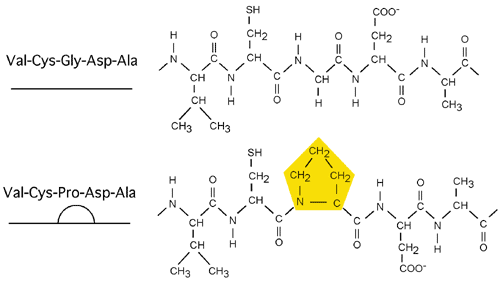
La proline étant un acide iminé dont l'azote alpha fait partie d'un cycle pyrrolidone. À cause de cela, la chaîne latérale de la proline, au lieu de s'étirer perpendiculairement à la chaîne principale du polypeptide, revient se coller dessus comme une anse de tasse:
Cette structure restreint beaucoup la rotation du lien N-Cα de la proline; l'angle Φ est limité à environ
-63 +/- 15 degrés. Cette restriction ne se prête pas à une structure en hélice alpha ou à un feuillet beta, chez qui elle peut causer une distortion (un coude dans une hélice alpha, par exemple), mais permet par contre d'autres types de structures: les hélices de proline.
La proline est pratiquement le seul acide aminé qui peut adopter une structure en cis de façon stable à cause de la faible différence en énergie entre ses formes cis et trans (elle a deux carbones liés au N).
|
|
|
Les conformations préférées de la proline sont ψ= 160° et φ= -75° pour la configuration cis; une répétition de prolines en cis donne une hélice de polyproline de type I ou PPI. L'hélice PPI tourne a droite.
La configuration trans a des angles de ψ= 145° et φ= -75°; une répétition de cette configuration donne une hélice de proline dite de type II (ou PPII); cette hélice tourne à gauche. Une hélice PPII peut tolérer d'autres acides aminés, le plus souvent Q, S, R ou A.
On n'a pas encore rencontré d'hélice PPI dans les protéines. Par contre, les hélices PPII ont une importance biologique indéniable: le domaine SH3 (src-homology 3) de plusieurs récepteurs lie des ligands de conformation PPII.
2.2.4.4 L'hélice de collagène.
Cette hélice qui tourne à gauche s'apparente à l'hélice PPII. Elle a une structure fort particulière: chaque troisième résidu y est une glycine, et près de la moitié des autres est une proline. Elle est aussi très riche en résidus modifiés comme l'hydroxylysine et l'hydroxyproline.
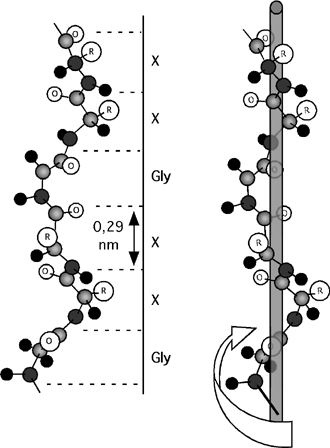
L'hélice de collagène est vue plus en détails à la section 3.7, car elle contient aussi plusieurs acides aminés modifiés et servira de modèle pour résumer les trois premiers chapitres.
benoit.leblanc@usherbrooke.ca







