Suivez ce lien pour la page des réponses.
Questions de révision sur le chapitre 1
Question 1.1: L'histidine, la lysine et l'arginine sont trois acides aminés basiques. Le pK de leur chaîne latérale est respectivement d'environ 6, 10,5 et 12,5. Lesquels de ces acides aminés sont les plus basiques? Et quel serait leur caractère à un pH à peu près neutre?
Question 1.2: L’aspartame, cet édulcorant bien connu, est un simple dipeptide: l’aspartylphénylalanine méthyl ester. C’est le groupement carboxylique libre de la phénylalanine qui est estérifiée en C-O-CH3. Dessinez la structure de l’aspartame (vous pouvez aller voir à quoi ressemblent la phénylalanine et l'acide aspartique si vous voulez). Ionisez les groupes comme si le pH était à 7. Quels seraient les groupes à considérer pour estimer le pI de l’aspartame?
Question 1.3: La proline est un acide iminé plutôt qu'aminé. Quelle est sa caractéristique principale donnant de l'importance à cette distinction?
Question 1.4: Lequel de ces peptides est le plus acide globalement à pH7? Le plus hydrophobe?
(a) MRHDCEILDFEWDEAGGEGDSETD
(b) MHGFHIKLKDKQLRRKKIPREWDKL
(c) FWYKPYWFVNAAVFWYALCDFYR
(d) AQNDFMLKCSEFKDYTREDCAQRD
Question 1.5: Certains organismes utilisent certains codons d'une manière différente; par exemple, en utilisant un codon CTG pour une sérine plutôt qu'une leucine. Quelles sont selon vous les limitations imposées à ce phénomène d'utilisation différentielle?
Question 1.6: Petit exercice sur l'internet. Rendez-vous sur le site du NCBI et cherchez les séquences en acides aminés des récepteurs nucléaires RXR alpha1, RXR beta1, et RXR gamma2 de la souris (mus musculus). Sauvez ces séquences quelque part en format texte et rendez-vous ensuite sur le site de l'institut européen de bioinformatique. Vous y trouverez une liste de plusieurs outils bioinformatiques. Choisissez le programme ClustalW qui sert à faire des alignements. (ClustalW est disponible ailleurs, aussi ne vous gênez pas si vous préférez un autre site). Pour comparer les trois séquences, copiez-collez chacune d'entre elles dans la fenêtre à cet effet, l'une à la suite de l'autre, en les séparant par le symbole > et le nom de la protéine, suivie par un point. Comme ceci:
>RXRalpha1.
sequencesequencesequencesequence
>RXRbeta1.
sequencesequencesequencesequence
>RXRgamma2.
sequencesequencesequencesequence
En comparant l'alignement des trois séquences, où remarque-t-on le plus de disparité entre elles?
Réponses pour le chapitre 1.
Questions de révision, chapitre 2
Question 2.1: Nommez trois types de liens qui peuvent aider à stabiliser la structure d’une protéine et nommez un agent qui peut contrecarrer chacun de ces liens.
Question 2.2: Un cristal de déoxyhémoglobine mis en présence de l'air se brise spontanément. Expliquez pourquoi et dites s'il s'agit d'un problème de structure primaire, secondaire, tertiaire ou quaternaire.
Question 2.3: Vrai ou faux?
(a) Un acide aminé fréquemment présent dans une hélice alpha est très rare dans un feuillet beta.
(b) Une hélice alpha est forcément hydrophobique
(c) Un feuillet beta s'étire très mal
(d) Une protéine devrait spontanément adopter sa structure tertaire, si on lui en donnait le temps
(e) Les chaperons aident à faciliter le repliement adéquat des protéines
Question 2.4: Une protéine contenant plusieurs ponts disulfures dans sa structure a besoin d'être chauffée davantage qu'une autre pour être dénaturée, précisément parce que les ponts disulfures (qui sont des liens covalents formés par l'oxydation de la cystéine et sont donc très solides) stabilisent la structure. Quel serait un moyen d'abaisser la température de dénaturation d'une telle protéine?
Question 2.5: Pourquoi une fibre de kératine peut-elle être étirée beaucoup mieux qu'une fibre de collagène? Elles sont pourtant toutes les deux hélicales. Et pourquoi la soie, composée surtout de feuillets beta, est-elle difficile à étirer?
Question 2.6: William Astbury a découvert que le patron de diffraction des rayons X par la laine montrait une structure répétée, avec une unité structurale espacée d'environ 0,54nm en direction de l'axe de la fibre. En chauffant la laine à la vapeur et en l'étirant, il obtenait la même unité répétée, mais avec une valeur de 0,70nm. En réchauffant la laine à la vapeur de nouveau, et en la laissant rétrécir, il retrouvait une valeur de 0,54nm. Bien que cette observation ait fournie un important indice quant à la structure moléculaire de la laine, Astubry ne fut pas capable de l’interpréter à l'époque. Étant donnée votre compréhension actuelle de la structure des protéines, interprétez l'observation d'Astbury.
Question 2.7: 16- Vous recherchez une protéine qui interagit avec l’hélice amphipathique d’un facteur de transcription de type leucine-zipper. Vos travaux de purification vous permettent d’isoler trois candidats dont voici une partie de la séquence en acides aminés. Lequel des candidats est le plus prometteur? Et pourquoi?
1: GQHGPIGPAGPKGPAG
2: EAFGHEWCQFLQCLQE
3: LILFIQEDFDAGKKELL
Question 2.8: Il existe, chez plusieurs espèces, des protéines antigel. Expliquez pourquoi la structure de ces protéines n’est pas toujours la même malgré le fait qu’elle réussissent toutes à empêcher la croissance de cristaux de glace.
Réponses pour le chapitre 2.
Questions de révision sur le chapitre 3
Question 3.1: Le cuir est le produit du traitement de la peau des animaux avec des substances appelés tannins. Expliquez comment les tannins peuvent prévenir cette peau traitée d'une putréfaction rapide, et comment elle rend le cuir hydrofuge.
Question 3.2: Pour quelle raison la glycine se retrouve-t-elle répétée à tous les trois résidus dans une triple hélice de collagène?
Question 3.3: Clostridium perfringens est une bactérie anaérobique très pathogène qui cause une forme de gangrène (ou destruction des tissus infectés). Cette bactérie synthétise un enzyme qui coupe avant le tripeptide Glycine-Proline-Tyrosine. Comment cet enzyme peut-il particulièrement expliquer le pouvoir invasif de Clostridium dans les tissus?
Question 3.4: Expliquez comment une modification comme la glycosylation d'une protéine peut expliquer l'insensibilité du cobra à son propre venin.
Question 3.5: Suggérez un mécanisme permettant à une drogue d'interférer avec la signalisation pro-cancéreuse de la protéine Ras.
Question 3.6: Les résidus les plus souvent retrouvés au coeur des protéines globulaires sont Ala, Val, Leu, Ile, Phe, Met, Cys, et Gly. Expliquez pourquoi.
Question 3.7: Parmi les modifications suivantes, lesquelles jouent un rôle sur la charge des protéines?
(a) phosphorylation (b) acétylation (c) carboxylation (d) S-acylation
Question 3.8: En quoi la sumoylation peut-elle contrer le mécanisme de dégradation de l'ubiquitine?
Réponses pour le chapitre 3.
Question de révision sur le chapitre 4
Question 4.1: Le méthanol est extrêmement toxique parce qu’il est converti en formaldéhyde lors d’une réaction catalysée par l’enzyme alcool déhydrogénase:
NAD+ + methanol (CH3OH) ---> NADH + H+ + formaldehyde (HCHO)
Le traitement dans le cas d’ingestion de méthanol inclut l’administration d’une quantité d’éthanol sufisante pour complètement intoxiquer quelqu’un. Expliquez pourquoi on donne ainsi de l’éthanol au patient, en fonction de ce que vous savez du fonctionnement des enzymes.
Question 4.2: Sur le graphique suivant, dessiner la courbe correspondant à l'effet d'un inhibiteur compétitif, puis à celle d'un inhibiteur non-compétitif.
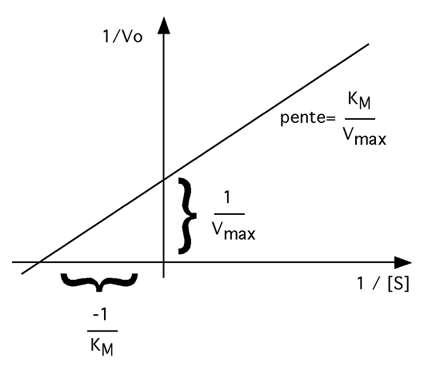
Question 4.3 Vrai ou faux? Une réaction enzymatique induit une modification structurelle irréversible de l'enzyme.
Question 4.4 Quel est l'effet, sur le Vmax d'un enzyme, d'un inhibiteur non-compétitif?
Question 4.5 Quel est l'avantage à ce qu'un enzyme soit inhibé par le produit de sa réaction?
Question 4.6 Un inhibiteur compétitif peut-il être irréversible?
Réponses pour le chapitre 4.
Question de révision pour le chapitre 5
Question 5.1 Un polypeptide digéré par une protéase libère les peptides suivants. Ils sont purifiés sur une colonne échangeuse de cations. Donnez l’ordre de leur élution à pH 7 en utilisant un gradient de KCl de 100mM à 1M. Justifiez votre choix.
EEEDFPPGPHRQKKK
GGILPA
TSGKAY
GHACGF
DDEDEAA
VNRKGW.
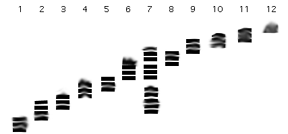
Question 5.2 Un purification par gradient de sucrose donne 12 fractions séparés en partant du haut du tube. Sur gel SDS, voici ce qu’elles donnent comme patron. Que signifie le patron de la piste 7?
Question 5.3 Vous purifiez sur colonne d’échange d’ions, avec un tampon Tris à pH 7, un polypeptide de séquence
GGLDNREDSARTILEKKERIEDQTHTSGPQMRHNVMRHNKLILDED.
Quel moyen de détection recommandez-vous pour suivre l’élution du peptide? Justifiez votre réponse.
Question 5.4 Vous disposez d'un extrait cellulaire total duquel vous voulez extraire une glycoprotéine encore mal connue. Décrivez cinq techniques utilisées pour la purifier, si vous savez déjà qu'elle a un pI de 9, que sa séquence interne contient la séquence RRKGHHHHHHSM et qu'elle se lie à la protéine SP1. Justifiez vos choix et soulignez le ou les avantages de chacune des techniques que vous choisissez.
Question 5.5 Vous purifiez un enzyme qui contient quatre sous-unités de 65 kD.
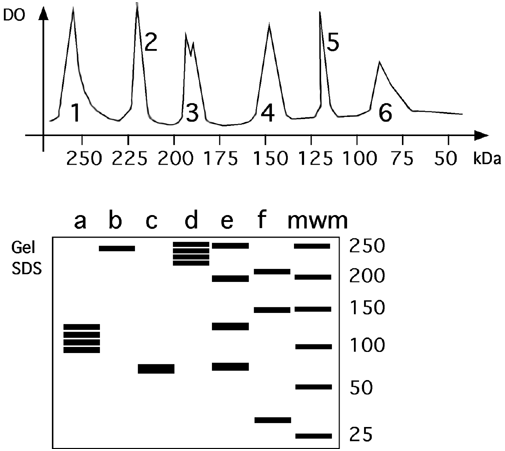
(a) Dans des conditions non-dénaturantes, dans quel pic d’élution d’une colonne de filtration sur gel (1 à 6, ci-dessous) vous attendez-vous à retrouver cet enzyme?
(b) Sur gel SDS, quelle piste contiendrait l’enzyme?
(c) Et si on pontait les protéines au dimethylsuberimidaqte avant la purification?
Réponses pour le chapitre 5.
Questions de révision sur le chapitre 6
Question 6.1 Un spectromètre de masse peut donner des indications sur...
(a) la masse
(b) la structure tertiaire
(c) la structure primaire
(d) a et b
(e) a et c
(f) b et c
Question 6.2 Comment un spectromètre de masse pourrait-il être utilisé pour séquencer un polypeptide?
Question 6.2 Pourquoi est-il important de déterminer l'identité de l'acides aminé se trouvant au bout d'un polypeptide pendant sa séquence par MS/MS?
Question 6.3 La microscopie de force atomique utilise-t-elle des lentilles optiques?
Question 6.4 Parmi les techniques suivantes, lesquelles peuvent être utilisées avec du matériel vivant?
(a) MS/MS
(b) Microscopie électronique à balayage
(c) microscopie à force atomique
(d) Protection à la DNAse I
(e) MALDI-TOF
Réponses pour le chapitre 6.
7.5 Questions de révision sur le chapitre 7
Question 7.1 Quelle est l’importance de la charge d’une protéine sur la migration du complexe ADN-protéine dans un test d’EMSA?
Question 7.2 Vous voilà responsable d’un étudiant d’été au labo. Votre jeune protégé est chargé d’exprimer dans E. coli une protéine de S. cerevisiae. Il doit d’abord cloner le gène de cette protéine, puis l’introduire dans les sites BamH I et EcoR I un vecteur d’expression.
Voici la séquence du gène:

L’étudiant décide de procéder par PCR et veut commander les oligonucléotides suivants pour aller “pêcher” le gène directement à partie du génome de S. cerevisiae:
5’ AAGGATCCATGGCTAGGATAGCAAGG 3’ et 5’ AAGAATTCCCTCTCCATAGCCAGAGC 3’
Vous approuvez sa stratégie, mais lui faites remarquer qu’il pourrait éviter bien des problèmes en modifiant la séquence et la longueur de ses oligos.
(a) Suggérez deux oligos plus avantageux, en ne dépassant pas 50 bases pour chacun d’entre eux.
(b) Expliquez votre choix.
Question 7.3 Pourquoi ne peut-on pas faire un gel de protéines de type SDS-PAGE, mais en omettant le SDS et le beta-mercaptoethanol pour que les protéines restent à l'état natif?
Question 7.4 Lors de la ligation d'un adapteur double-brin au bout d'un brin d'ADN lors d'une réaction de LMPCR, pourquoi l'adapteur a-t-il une extrémité prohéminente?
Réponses pour le chapitre 7.



