| Retour à la page d'accueil | Section précédente | Section suivante |
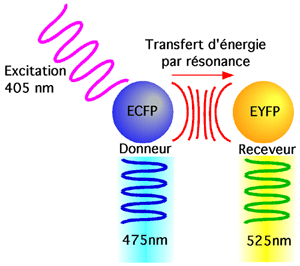
7.1.2 FRET (fluorescence resonance energy transfer)
|
Le FRET est une technique qui permet de détecter la proximité de deux molécules fluorescentes. La première, (dite le "donneur"), est excitée par une longueur d'onde λ1 (dans l'UV, par exemple). Le donneur va libérer des photons de longueur d'onde λ2 (dans le bleu, par exemple), qu'on peut détecter. Il peut aussi transférer par résonance une partie de son énergie d'excitation à la seconde molécule fluorescente (le "receveur") qui libérera aussi des photons, mais à une longueur d'onde qui lui est propre, λ3 (dans le jaune, par exemple). Puisqu'il y a transfert d'énergie entre le donneur et le receveur (et que rien ne se perd, rien ne se crée), plus le transfert d'énergie est efficace et plus le receveur émet de photons par rapport au donneur.
|

|
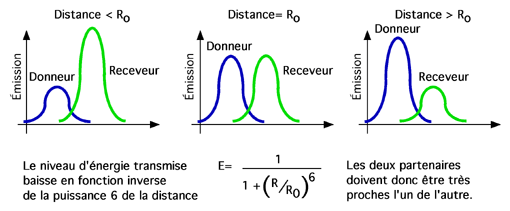
Le transfert d'énergie du donneur au receveur, souligné par la détection de l'émission de lumière λ3, indique que le donneur et le receveur ont été très proches l'un de l'autre car l'efficacité du FRET est proportionnelle à l'inverse de la puissance 6 de la distance entre les deux molécules.
Les deux molécules doivent être séparées par 10-100 Angstroms; le spectre d'absorption de l'accepteur doit chevaucher le spectre d'émission du donneur; et les orientations des dipôles du donneur et de l'accepteur doivent être à peu près parallèles.
La distance à laquelle le transfert est efficace à 50% est appelé distance de Förster et varie selon les agents fluorescents utilisés.
|
Donneur |
Accepteur |
Distance de Förster (R0) (Angstroms) |
| Fluorescein | Tetramethylrhodamine | 55 Å |
| IAEDANS | Fluorescein | 46 Å |
| EDANS | Dabcyl | 33 Å |
| Fluorescein | QSY7 et QSY9 | 61 Å |
| ECFP | EYFP | 50 Å |
Certains accepteurs ne fluorescent pas, mais en absorbant l'énergie du donneur ils causent une baisse de sa fluorescence qui peut être quantifiée. (Un tel accepteur non-fluorescent, dit "quencher" (ou "éteignoir"), est utilisé dans le système TaqMan de PCR quantitatif).
Une forme de FRET utilise des protéines fluorescentes comme donneur et accepteur; cette approche permet d'utiliser le FRET dans un contexte in vivo. On lui donne parfois le nom de BRET pour Bioluminescent Resonance Energy Transfer. On s'en sert dans les cellules vivantes en incitant celles-ci à produire des protéines de fusion avec des domaines naturellement fluorescents, comme les variantes de la GFP (green fluorescent protein) que sont la ECFP (enhanced cyan fluorescent protein) ou la EYFP (enhanced yellow fluorescent protein). Le rayon de Förster entre la ECFP et la EYFP est de 50Å.
7.1.3 Co-précipitation
Si nous avons le moyen de faire sédimenter une protéine en particulier, par immunoprécicpitation par exemple, on peut espérer que nous puissions aussi faire en mnême temps sédimenter un complexe dont elle ferait partie.
Une co-immunoprécipitation utilise un anticorps contre une protéine X, sur laquelle une protéine Y vient d'habitude se coller. L'anticorps qui a reconnu X est immobilisé par une bille de protéine A sepharose, permettant la sédimentation du complexe bille-anticorps-X-Y.
Comme chaque anticorps a ses caprices, on a recours la plupart du temps à une variante de ce concept: on introduit à une des extrémités de la séquence codante de X une étiquette qui peut être reconnue par un anticorps commercial (ou par tout autre agent faisant notre bonheur). Ainsi, si on utilise une étiquette portant l'épitope FLAG de Sigma, on utilisera un anticorps anti-FLAG pour récupérer le complexe X-Y; si on utilise une étiquette GST (gluthatione-S-transférase) on se servira de glutathione-sepharose, sans anticorps, puisque la GST se lie spontanément à la glutathione. Si on utilise une étiquette de six histidines, on pourra utiliser des billes de sepharose Ni-NTA. On a même recours a des étiquettes complexes, comme l'étiquette TAP (pour tandem affinity purification) qui combine un site de liaison à la calmoduline à un site d'affinité pour les IgG tiré de la protéine A. Ce type d'étiquette permet une double purification.
7.1.4 Combinaisons de buvardages
Dans la technique du Southwestern blot, on combine un buvardage de type western à un transfert de type Southern. Les protéines sont d’abord transférées sur une membrane, puis incubées dans des conditions qu’on espère suffisament douces pour que les protéines se renaturent partiellement. On ajoute ensuite une sonde d’ADN radioactive. S’il y a une interaction spécifique entre certaines protéines et l’ADN, celui-ci sera localisé sur une ou plusieurs bandes particulières sur la membrane. (Vous devinez que ce genre de technique donne un bruit de fond très important).
Cette technique est très simple, mais aussi très élégante et a permis de démontrer que la protéine GCN5 avait une activité histone acétyltransférase. On prépare d'abord un gel SDS normal, à ceci près que sa matrice contient aussi une cible quelconque (dans le cas de l'expérience mentionnée, cette cible consistait d’histones). La cible est aussi retrouvée dans le tampon. Bref, tout le système est saturé en cible.
Cette technique utilise à son profit la nature modulaire de certains domaines protéiques, comme le domaine d’attache à l’ADN du facteur de transcription de levure Gal4 et le domaine d’activation de la transcription viral VP-16.
Expérience de double hybride
On peut aussi s’y prendre à l’envers, et transférer d’abord l’ADN sur une membrane de nylon; on l’incube ensuite avec un extrait protéique. Si une protéine se lie à l’ADN, on pourra la révéler grâce à un anticorps spécifique. Bien entendu, pour que le système fonctionne, l’interaction ADN-protéine doit être assez stable pour se maintenir tout au long du traitement par les anticorps primaire et secondaire.
On a parfois aussi parlé de “far western blot”. Cette technique au nom géographiquement pittoresque immobilise d'abord une protéine X sur une membrane qui est ensuite mise en présence de protéine Y. S'il y a interaction entre les deux, un anticorps anti-Y devrait signaler sa présence dans le voisinage de X plus qu'ailleurs sur la membrane.
7.1.5 Réaction à même le gel, ou zymogramme
On dépose un extrait protéique dans les puits et on fait migrer le gel pour bien en séparer les protéines. Aprèes la migration, on lave le gel pour le débarasser du SDS pour permettre aux protéines de se renaturer, dans un tampon au pH et à la salinité appropriée.
On fournit ensuite le substrat qui permet de suivre la réaction qui nous intéresse. Dans le cas des histones acétyltransférases, il s'agissait d'acétyl-CoA radioactif. Une histone acétyltransférase devrait transférer le groupe acétyl radioactif de l’acétyl-CoA sur les histones qui sont à sa portée.
La réaction, si elle a lieu, se produira dans le gel à la hauteur de l'enzyme qui possède l'activité, puisqu'il y a de la cible partout mais que l'enzyme ne se trouve qu'à un seul endroit. il est alors facile de récupérer la bande contenant l'activité et de la faire analyser par spectrométrie de masse.
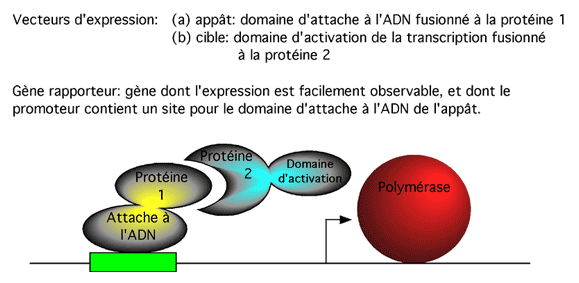
7.1.6 Double hybride
Pour évaluer l’interaction entre une protéine 1 et une protéine 2, on commence par en faire des hybrides par génie génétique: un premier hybride entre la protéine 1 et un domaine d’attache à l’ADN, et un second entre la protéine 2 et un domaine d’activation de la transcription.
On transfère ensuite les vecteurs d’expression de ces hybrides dans une levure contenant un gène rapporteur (comme la beta-galactosidase) sous le contrôle d’un promoteur reconnu par le domaine d’attache à l’ADN de l’hybride 1.
L’hybride 1 va se lier au promoteur. Si les protéines 1 et 2 ont réellement de l’affinité l’une pour l’autre, l’hybride 2 va entrer en contact avec l’hybride 1 et se trouver positionné au promoteur lui aussi, là où son domaine d’activation de la transcription stimulera l’expression du gène rapporteur.
L’interaction entre les protéines 1 et 2 mènera donc à l’activation du gène rapporteur, même si les protéines 1 et 2, dans leur contexte naturel, n’ont rien à voir avec l’expression des gènes.
Retour à la page d'accueil Section précédente
Section suivante