| Retour à la page d'accueil | Section précédente | Section suivante |
5.4.1 Généralités
La source de notre matériel peut ne pas être sujette à discussion. Si nous étudions des protéines dans leur contexte naturel, nous n'avons d'autre choix que d'aller les y chercher.
Cependant, si nous pouvons sans conséquences fâcheuses utiliser une source alternative, nous devrions sérieusement le considérer si cette alternative se révèle plus disponible, moins onéreuse ou plus commode à utiliser.
Autant que faire se peut, pour obtenir de grandes quantités de protéines, nous devrions opter pour une méthode quelconque de surexpression. Alors qu'une protéine dans son contexte naturel ne représente qu'une fraction infime du pourcentage de la masse totale des protéines, une protéine surexprimée peut en représenter une fraction impressionante.
La surexpression passe souvent par la construction d'un vecteur d'expression qui contiendra la séquence codant pour notre protéine: la construction d'un tel vecteur est une occasion en or pour introduire dans la séquence une étiquette favorisant la purification ou l'identification de la protéine.
Le tableau qui suit présente les caractéristiques de différentes sources de protéines exprimées à partir d'un vecteur d'expression.
| Bactérie | Levure | Insecte | Mammifère | in vitro | |
| Facilité du procédé | +/- complexe, lent | +/- complexe, lent | complexe, lent | complexe, lent | simple, rapide |
| Expression | rapide | rapide | assez lente | assez lente | très rapide |
| Production | élevée | élevée | moyenne | moyenne | faible |
| milieu | pas cher | pas cher | coûteux | couteux | couteux |
| protéine sécrétée? | souvent, avec aussi corps d'inclusion | souvent | parfois | rarement | ne s'applique pas |
| purification | simple | simple | assez simple | assez simple | simple |
| co-expression | difficile | difficile | assez facile | difficile | facile |
| Interférence avec l'hôte | rarement | rarement | rarement | rarement | non |
| Repliement correct | pas toujours | pas toujours | oui | oui | pas toujours |
| N-glycosylation | non | oui, riche en mannose | simple, pas d'acide sialique | complexe | non |
| O-glycosylation | non | oui | oui | oui | non |
| phosphorylation | sur Tyr; très rare sur Ser et Thr | oui | oui | oui | non |
| acétylation | non | oui | oui | oui | non |
| acylation du N-terminus | non | oui | oui | oui | non |
| gamma- carboxylation | non | non | non | oui | non |
5.4.2 Tissu
Travailler avec du tissu comme source de matériel peut être indispensable, mais ce n'est certes pas commode. Le tissu devra souvent être brisé (à la moulinette ou au blender!) et/ou traité à la collagénase pour en briser les fibres insolubles et très solides. Un avantage est que la protéine vient de son milieu naturel; un autre est que le tissu en question est peut être vendu à prix très avantageux (un boucher vous vendra du thymus, sous le nom de ris de veau, à coups de kilogrammes).
5.4.3 Cellules en culture
Probablement la source la plus courante de protéines non-exprimées dans un système recombinant procaryote. Les cellules en culture sont très proches, physiologiquement parlant, de ce qui se passe dans un être vivant. Elles sont aussi généralement très faciles à traiter pour faire un extrait cellulaire. Malheureusement, la plupart demandent des conditions de culture exigeant l'utilisation de réactifs et de nutrients très onéreux; en outre, plusieurs types de cellules poussent lentement et ne donnent pas beaucoup de matériel.
5.4.4 Les levures
Si nous étudions une protéine qui se retrouve aussi bien chez ces eucaryotes plus primitifs que dans notre modèle habituel, alors les levures constituent une excellente source de matériel. Les conditions de culture pour les levures sont élémentaires, elles peuvent donner énormément de matériel, et elles ont l'avantage (par rapport aux procaryotes) d'être plus près, évolutivement parlant, des eucaryotes supérieurs. On y retrouvera donc des enzymes, comme les sérine-thréonine kinases, que ne possèdent pas les vecteurs d'expression procaryotes.
Certaines levures, comme Picchia pastoris, peuvent permettre l'expression d'énormes quantités de matériel.
La levure Saccharomyces cerevisiae, compactée et vivante, peut être achetée chez un boulanger grossiste en paquets de un kilo ou plus... quand on songe à ce que ça coûte pour obtenir 100g de cellules en culture, il y a de quoi pleurer.
5.4.5 Les bactéries
Elles restent ce qui se fait de moins cher et de plus puissant en fait de manufactures moléculaires. Les bactéries peuvent être utilisées pour exprimer des quantités astronomiques de matériel. Elles ont aussi été le sujet de plusieurs manipulations visant à en faire des vecteurs d'expression de plus en plus performants (consultez un catalogue Stratagene, par exemple, pour vous familiariser avec de nombreuses souches bactériennes qu'on a rendues déficientes en protéases, ou permettant l'expression de protéines toxiques, ou que sais-je encore).
L'utilisation d'un plasmide bactérien à partir duquel exprimer une protéine a de nombreux avantages, dont le principal est certes la facilité. Il suffit de cloner la séquence codant pour notre protéine dans un tel plasmide, en aval d'un promoteur qui fonctionnera dans la bactérie-hôte choisie, et de transformer la bactérie avec le plasmide ainsi fabriqué. Si le plasmide porte un gène de sélection (un gène de résistance à un antibiotique, par exemple) en plus d'une origine de réplication, on n'a pas à se soucier d'intégration ou de quoi que ce soit de ce genre.
De très nombreux vecteurs de clonage, prévu pour l'expression dans Escherishia coli, sont disponibles commercialement. Nombre d'entre eux contiennent des sites de clonage sous le contrôle de polymérases virales et non bactérienne (comme la T7 RNA polymerase), et sont destinés à être utilisés en conjonction avec des souches modifiées pour exprimer une telle polymérase -souvent sous le contrôle d'un système activable, comme celui de l'opéron gal. L'avantage d'une telle approche est que, par exemple, tant que le répresseur gal n'est pas inactivé par du galactose ou de l'IPTG, la polymérase T7 n'est pas synthétisée... et la protéine recombinante que nous voulons faire exprimée ne l'est pas non plus. En outre, on peut traiter nos cultures avec un inhibiteur d'ARN polymérase qui n'agit pas sur la polymérase virale: ainsi, on sait que suite à l'activation, seule notre protéine est exprimée. Cela réduit le bruit de fond causé par la présence des protéines endogènes de la bactérie.
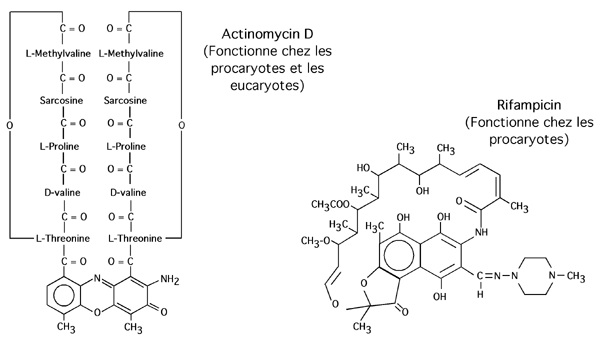
Voici deux inhibiteurs d'ARN polymérase:

5.4.6 Les virus
Une approche intéressante pour la production de protéines par des cellules eucaryotes est d'en introduire la séquence codante dans le génome d'un virus, puis d'utiliser celui-ci pour infecter des cellules.
On utilise beaucoup le baculovirus pour infecter des cellules d'insectes. Ce système est très efficace. On doit cependant se souvenir de ce que la glycosylation protéique chez les insectes n'est pas exactement la même que chez les mammifères. Si cet aspect est important pour nous, il convient de ne pas l'oublier.
Le virus de la vaccine offre un autre système d'expression. Il peut fonctionner dans des cellules humaines. En plus, l'infection par la vaccine cause l'arrêt de la transcription et de la traduction des protéines de l'hôte (seules les protéines venant du virus sont exprimées), ce qui enrichit notre protéine recombinante par rapport au bruit de fond. Le problème ici est que la vaccine est un virus vivant qui peut se transmettre à l'utilisateur (et la vaccination contre la petite vérole a été interrompue il y a déjà quelques lustres).
5.4.7 Le homard
À ce que je sache, personne n'utilise encore le homard de façon régulière pour l'expression des protéines.
| Retour à la page d'accueil | Section précédente | Section suivante |