| Retour à la page d'accueil | Section précédente | Section suivante |
Pratiquement toutes les réactions chimiques dignes de mention dans la cellule sont catalysées par des enzymes. La cellule a donc besoin d'un système fiable de régulation pour gérer toute cette activité bourdonnante. Imaginez seulement une cellule dont tous les enzymes seraient en action en même temps. Ce serait comme une grande ville dont tous les feux de circulation seraient au vert.
Le systèmes de régulation sont nombreux; on pourrait les classer de différentes façons selon leur rôle, leur importance ou leur pertinence en biologie moléculaire. Nous allons faire un survol des aspects qui suivent, certains pouvant se recouper: (1) inhibition ou activation par des macromolécules; (2) disponibilité de cofacteurs; (3) rétroaction et allostérie; (4) inhibitioncompétitive, non-compétitive, et par le substrat; (5) modifications covalentes. 4.9.1 Régulation par des macromolécules
Il existe de nombreuses protéines dont le rôle est d'inhiber l'action de certains enzymes. Ces inhibiteurs peuvent agir sur l'activité enzymatique proprement dite, ou dissimuler son site actif, ou séquestrer l'enzyme dans une partie de la cellule où il ne peut pas tenir son rôle,. À l'inverse, certaines interactions avec d'autres protéines vont permettre aux enzymes de se trouver là où leur activité peut avoir un rôle à jouer dans la régulation du métabolisme; qu'on pense seulement aux nombreux co-activateurs de la transcription qui possèdent une fonction acétyltransférase; ils n'ont pas beaucoup d'utilité tant qu'ils n'ont pas été recrutés au niveau de promoteurs de gènes particuliers.
4.9.2 Disponibilité de cofacteurs
Qu'il s'agisse de coenzymes, de groupements prosthétiques ou de simples ions, les cofacteurs sont nécessaires à tous les apoenzymes. La cellule a beaucoup recours à l'échange de cofacteurs, permettant d'activer ou d'inactiver rapidement un enzyme selon le cofacteur auquel il se lie.
La présence d' ions métalliques comme le Zn2+, le Fe2+, le Mn2+, le Mg2+ est aussi très souvent primordiale pour la fonction enzymatique. C'est pourquoi les cellules ont des sytèmes permettant à ces métaux de pénétrer le cytoplasme, malgré le risque qu'il peuvent aussi lui faire courir (la plupart des métaux lourds sont rapidement mortels pour une cellule), En purification protéique, l'une des plus élémentaires mesures de précaution pour protéger nos protéines des protéases est d'ajouter une certaine quantité de comnposé chélateur (EDTA, EGTA) aux tampons pour priver les protéases de leurs cofacteurs métalliques.
4.9.3 Rétroaction et allostérie
La rétroaction est l'action qu'a le produit d'une réaction sur cette dernière.
S'il s'agit d'une inhibition, nous parlons d'une rétroaction négative. Par exemple, la conversion de la thréonine en isoleucine est le fruit de l'activité de cinq enzymes en séquence, le premier étant la thréonine déhydratase. Le produit de cette conversion, l'isoleucine, est un inhibiteur de cet enzyme; ainsi, quand la réaction a donné le résultat attendu, la production d'isoleucine est arrêtée (n'utilisant pas plus de thréonine que nécessaire).
Le cas de la thréonine déhydratse est un bel exemple de régulation allostérique. Un enzyme allostérique contient plus d'un site: en plus de son site actif, il a un site régulateur (le nom allostérique vient d'ailleurs du grec allos (autre) et stereos (espace ou site). La molécule qui vient se fixer au site régulateur est appelé effecteur ou modulateur. Tout comme le site catalytique de l'enzyme est spécifique pour son substrat, le site allostérique est spécifique pour son modulateur.
On peut bien entendu observer un effet allostérique positif. Le modulateur dans un tel cas va favoriser l'activité de l'enzyme au lieu de lui nuire. C'est ce qu'on observerait dans une boucle de rétroaction positive dans laquelle le produit d'une cascade enzymatique irait stimuler un ou plusieurs enzymes y étant impliqués.
Un enzyme allostérique qui est modulé par son propre substrat est dit homotrophique; s'il est modulé par une autre substance il est dit hétérotrophique.
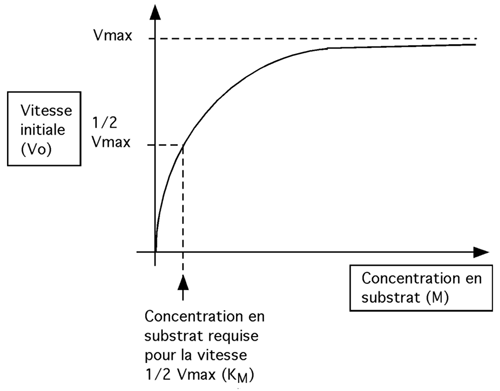
Les enzymes allostériques dévient de la règle michaélienne de comportement face au substrat. Un enzyme allostérique homotrophique stimulé par la présence de son propre substrat, au lieu d'avoir une relation hyperbolique comme celle de la figure ci-dessous,

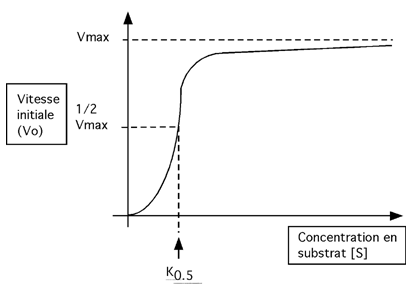
Parce que cette courbe n'obéit pas à la cinétique michaélienne, on ne peut pas définir de KM en fonction de 1/2 Vmax. On note quand même une concentration de substrat équivalent à 1/2Vmax, valeur qu'on désigne par K0,5.
Une telle courbe est aussi typique de la dynamique de capture de l'oxygène par l'hémoglobine: le premier oxygène est le plus difficile à attraper, parce que sa liaison induit un changement conformationnel qui facilite la capture des trois suivants. Ainsi qu'on pourrait s'y attendre, la myoglobine (qui comme l'hémoglobine capture de l'oxygène, mais n'a qu'une seule sous-unité globine au lieu de quatre) donne, elle, une courbe hyperbolique plutôt que sigmoïde.
4.9.4 inhibition comnpétitive, non-compétitive, et par le substrat
La forme la plus extrême de l'inhibition de l'activité d'un enzyme par une autre substance (à part, peut-être, la destruction de l'enzyme!) est l'inhibition irréversible. Cette inhibition, le plus souvent causée par la formation d'un lien covalent entre l'enzyme et l'inhibiteur, cause la perte définitive de l'activité enzymatique de l'enzyme.
L'insecticide malathion, par exemple, est un inhibiteur irréversible de l'acétylcholinestérase des insectes. Il se lie de façon covalente au groupement hydroxyl de la sérine du site actif de l'enzyme, l'inactivant pour de bon. Le PMSF, un agent fréquemment utilisé dans la préparation des protéines, inhibe les sérine et cystéine protéase en sulfonylant leur site actif. Lui aussi est irréversible.
Un inhibiteur réversible, comme vous le devinez, permet à l'enzyme de retrouver son état normal quand l'inhibiteur est retiré. Un tel inhibiteur peut être compétitif, c'est à dire qu'il compétitionne avec le substrat pour le site actif, qu'il occupe de façon à perturber la réaction, ou non-compétitif, c'est àa dire qu'il agit à un autre niveau. Un inhibiteur non-compétitif pourrait se lier à l'enzyme sur un autre site et interférer d'une manière ou d'une autre avec son activité, ou il pourrait avoir une action secondaire telle que la chélation d'un cofacteur essentiel à l'enzyme (ce que fait l'EDTA, un inhibiteur de protéase également fréquent).
Pour un enzyme de type michaélien, la différence entre une inhibition compétitive et non-compétitive se voit bien avec le graphique de Lineweaver-Burke:
Dans le cas d'une inhibition non-compétitive, quelque chose empêche l'enzyme de fonctionner correctement, indépendamment du substrat. La concentration de substrat requise pour atteindre 1/2 Vmax reste inchangée; c'est juste que le Vmax de l'enzyme baisse proportionnellement à la concentration d'inhibiteur non-compétitif.
L'inhibition par le substrat se présente quand il existe deux sites dans un enzyme pour le même substrat, mais quand l'un des deux sites a une faible activité catalytique et une faible affinité. La vitesse de l'enzyme devrait croître quand on augmente la quantité de substrat. Dans le cas qui nous occupe, cependant, il arrive un moment où la concentration de substrat est telle que même le site de faible affinité finit par avoir accès au substrat. Comme ce second site n'est pas très efficace, cependant, il peut nuire à l'action du premier sans lui-même compenser par sa propre activité. Quoiqu'un modèle intéressant, ce n'est pas un cas très courant. 4.9.5 modifications covalentes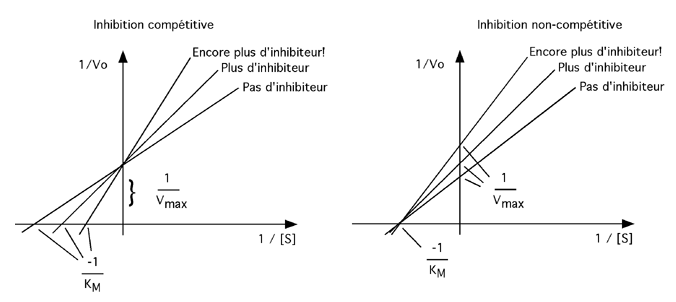
Dans le cas d'une inhibition compétitive, le problème est que le site de l'enzyme est souvent occupé par un obstacle. La vitesse maximale de l'enzyme n'est cependant pas affectée, puisque l'enzyme, lui, fonctionne très bien: c'est l'accessibilité du substrat qui est mise en cause. À une concentration suffisemment élevée de substrat, la concentration de compétiteur deviendrait négligeable et la vitesse maximale serait atteinte. Cependant, plus il y a d'inhibiteur, plus il faut de substrat pour compenser; par conséquent, la concentration de substrat pour atteindre la moitié de la vitesse maximale est aussi plus élevée et le KM augmente avec la concentration d'inhibiteur.
Nous avons vu comment un précurseur inactif peut être activé quand on lui fait subir une protéolyse limitée (exemple de la chymotrypsine).
D'autres modifications incluent le transfert de groupements chimiques. Il existe des systèmes de phosphorylation / déphosphorylation, méthylation / déméthylation, acétylation / déacétylation qui justement activent ou inactivent plusieurs enzymes.
| Retour à la page d'accueil | Section précédente | Section suivante |