| Retour à la page d'accueil | Section précédente | Section suivante |
4.6 Structure et fonction
Un enzyme est beaucoup plus volumineux que son substrat. Il semble qu'on ait besoin d'une architecture fort complexe pour permettre à quelques acides aminés de se trouver juste dans la position qu'il faut pour servir de catalyseur à une réaction. La structure de l'enzyme sera donc déterminante pour sa fonction.
Plusieurs facteurs entreront en ligne de compte pour le bon fonctionnement d'un enzyme. Comme la rencontre entre l'enzyme et son substrat dépend du mouvement moléculaire, l'activité d'un enzyme croîtra avec la température (puisque la température est le reflet du mouvement moléculaire). Cependant, cela ne sera plus vrai quand la température sera assez haute pour affecter la structure tertiaire de l'enzyme: il pourrait alors perdre rapidement son activité. Un enzyme dénaturé (c'est à dire qui a perdu sa structure tertaire) ne peut pas fonctionner.
Le pH aura le même effet. L'état d'ionisation des différents acides aminés d'une protéine aura une grande influence sur sa structure, et indépendamment de la structure on doit aussi considérer l'état d'ionisation des acides aminés du site actif. Les enzymes auront par conséquent des pH optimaux différents, selon leur structure et la nature de leur site actif. La pepsine a un pH optimal de 1,5, approprié pour un enzyme gastrique; la trypsine intestinale a plutôt un pH optimal de 7,7).
La forme du site actif de l'enzyme va lui permettre de reconnaître un substrat particulier: le substrat est la clef dont le site actif est la serrure. Certains enzymes sont extrêmement spécifiques et ne fonctionneront que sur un seul et unique substrat; d'autres ont un large spectre et fonctionnent sur une structure partagée par de nombreuses molécules qui peuvent toutes lui servir de substrat. Le site actif consiste d'au moins deux parties fonctionnelles, qui peuvent ou non être voisines sur la chaînes polypeptidique (si non, la structure tertiare les amène près l'une de l'autre). Ce sont le site de reconnaissance du substrat et le site catalytique. Le premier permet à l'enzyme de reconnaître son substrat; le second de lui faire subir son traitement catalytique. La liaison du substrat implique souvent de nombreuses liaisons non-covalentes de type hydrophobique, des ponts hydrogènes, ou des interactions de van der Waals.
On retrouvera souvent une activité enzymatique associée à un domaine d'une protéine, et ce domaine peut parfois être transporté par ingénierie génétique sur une autre protéine. La nature a probablement favorisé la conservation de tels domaines au cours des nombreuses recombinaisons de gènes qui ont accompagné notre évolution.
De même, il n'est pas rare qu'une même protéine ait plusieurs activités enzymatique. Le facteur de transcription basal TFIID contient une polypeptide, TAFII250, qui combine des activités kinase, acétylase et ubiquitinyl-transférase.
4.6.1 Un exemple: la chymotrypsine.
La chymotrypsine, comme sa comparse la trypsine, est synthétisée dans le pancréas et sécrété dans l'intestin grêle sous forme d'un zymogène, la chymotrypsinogène. Sa forme active est une protéase à très large spectre: elle coupe le lien peptidique qui suit les acides aminés dotés d'une grosse chaîne latérale hydrophobique comme Trp, Tyr, ou Phe; elle peut aussi, plus faiblement, faire de même après Leu, Ile et la méthionine (avec une affinité décroissante dans l'ordre cité) et peut aussi agir avec une très faible affinité après une Histidine.
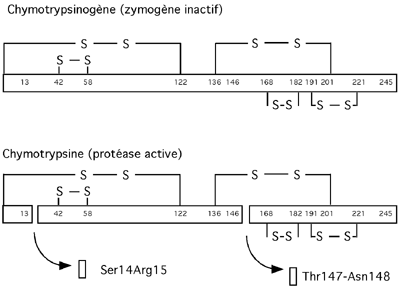
Le délai dans l'activation de la chymotrypsinogène protège le pancréas de la protéolyse par la chymotrypsine. L'activation se produit quand deux dipeptides sont retirés au chymotrypsinogène: Ser14-Arg15 et Thr147-Asn148.

Le mécanisme réactionnel de la chymotrypsine a été partiellement déduit à partir de sa structure. L'enzyme compte trois chaînes polypeptidiques (A, B et, sans surprise, C) reliées entre elles par des ponts disulfures ainsi que vu dans la figure ci-haut. Le site d'attache du substrat dans la chymotrypsine consiste en une région ressemblant à une crevasse bordée d'acides aminés hydrophobiques. La conformation de cette crevasse permet à ces acides aminés hydrophobes d'interagir avec les chaînes latérales hydrophobiques de W, F et Y présentes dans les substrats. Les petites chaînes latérales hydrophobiques (comme celle de la valine ou de l'alanine), de même que les chaînes latérales hydrophiles (toutes celles qui sont polaires) ne permettent pas les liaisons non-covalentes nécessaires à la liaison au site actif de l'enzyme.
Les protéines globulaires protègent la plupart de leurs résidus hydrophobiques à l'intérieur de leur structure; la chymotrypsine aurait donc du mal à aider à la digestion des aliments si ceux-ci ne transitaient pas d'abord dans l'estomac. Là, le pH très acide (entre 1 et 2) dénature la plus grande part des protéines, exposant leurs "entrailles", si l'on peut dire... entrailles qui sont partiellement dégradées par la pepsine et les autres enzymes gastriques. Ce sont donc des protéines déjà partiellement dégradées qui arrivent dans l'intestin pour être la cible de la chymotrypsine.
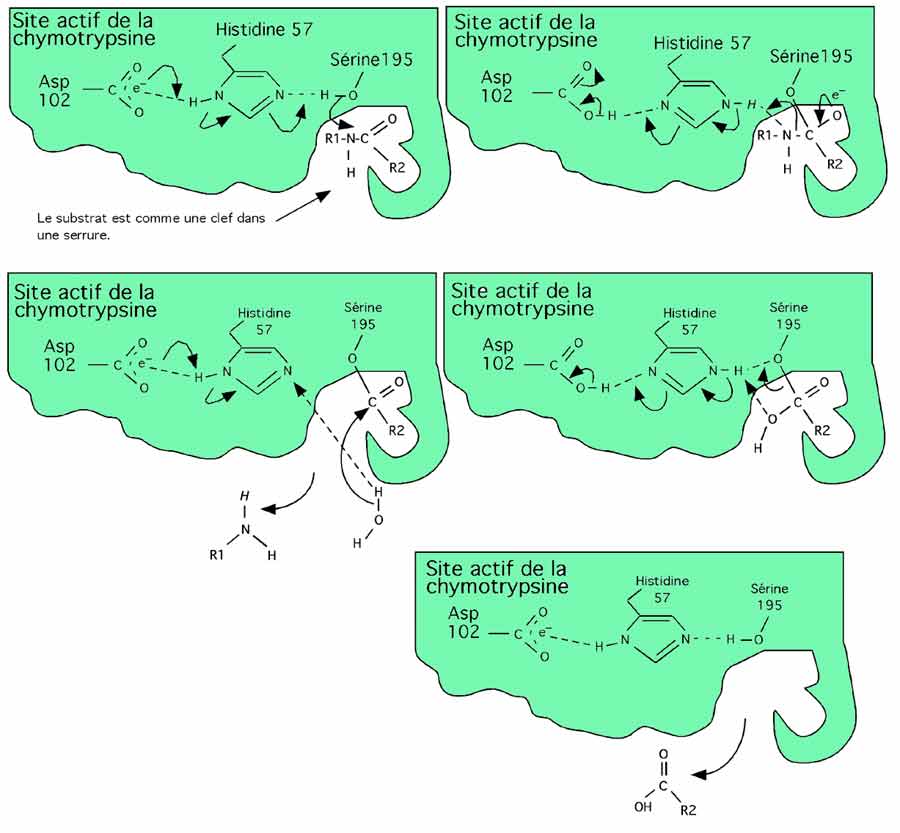
Mécanisme du site actif de la chymotrypsine. Le substrat, une chaîne polypeptidique avec une chaîne latérale hydrophobique comme W, F ou Y, est logé dans le site de reconnaissance de telle façon que le lien à être hydrolysé se retrouve près de la sérine 195. La chymotrypsine est une sérine protéase en raison du rôle que joue cet acide aminé dans son activité; le terme sérine protéase ne désigne pas une protéase coupant les sérines! Un transfert d'électrons initié sur l'aspartate 102, induisant l'histidine 57 à voler un hydrogène à la sérine active. Le O - qui reste à la sérine attaque le carbone du substrat, formant un lien covalent temporaire. L'hydrogène volé à la sérine, maintenant sur l'histidine, est attiré par le doublet électronique libre de l'azote du substrat (deuxième figure).
Cet azote vole à son tour l'hydrogène (en italique), ce qui brise le lien C-N du substrat et libère une moitié de la chaîne en train d'être digérée. Une molécule d'eau entre alors en jeu; un pont hydrogène avec l'histidine la met en présence du reste du substrat (troisième figure).
| Retour à la page d'accueil | Section précédente | Section suivante |