BCM-514
Biochimie des protéines
4.0 Les enzymes
4.4 Apoenzyme, coenzyme, holoenzyme, etc.
Les enzymes protéiques ne sont pas toujours homogènement composés d'acides aminés. Certains (en fait, beaucoup!) recquièrent aussi des composantes chimiques supplémentaires appelées cofacteurs.
Un cofacteur peut être inorganique, tels que le sont les ions Fe2+, Mn2+, Zn2+ ou Mg2+, des cofacteurs fréquents. Il peut aussi être de nature organique, comme la biotine ou le coenzyme A. La plupart des vitamines sont des cofacteurs enzymatiques. Quand un cofacteur est une molécule organique complexe, il porte le nom de coenzyme. La partie protéique de l'enzyme, elle, s'appelle apoenzyme et l'union de l'apoenzyme et de son coenzyme (ou de son cofacteur) est un holoenzyme.
Le cofacteur, qu'il soit petit comme un ion ou complexe comme un coenzyme, peut être attaché de façon transitoire à l'apoenzyme ou encore y être fixé de façon covalente; c'est alors un groupement prosthétique.
Finalement, un enzyme qui est synthétisé sous une forme inactive qui demande à être activée par protéolyse partielle est un zymogène.
4.4 Réactions chimiques et catalyseurs
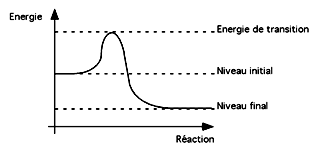
L'énergie individuelle des molécules dans une population varie beaucoup de part et d'autre d'une valeur moyenne. L'énergie d'une molécule particulière pourrait être suffisamment élevée pour lui faire passer le niveau d'une barrière d'énergie d'activation qui sépare cette molécule d'un autre état plus stable:
|
Le niveau d'énergie final est plus bas que le niveau initial; la réaction a donc fort peu de chances de se faire en sens inverse. Cependant, elle ne sera pas non plus systématiquement spontanée parce qu'entre le niveau d'énergie initial et le niveau d'énergie final (plus bas) il y a un niveau d'énergie de transition (l'énergie d'activation) qui est plus haut que les deux.
|
|
L'état dans lequel une molécule se trouve quand elle est au sommet de la colline (c'est à dire avec assez d'énergie pour changer d'état) et dit "état de transition", parce que la molécule pourrait soit franchir la barrière, soit revenir à son état antérieur. une fois la barrière franchie, le retour est extrêmement défavorisé.
Voici un exemple: un ballon au sommet d'une pente va rouler vers le bas sans nécéssiter d'aide, parce que son niveau d'énergie potentielle en haut de la pente est plus élevée qu'en bas. À moins qu'on lui fournisse activement de l'énergie, une réaction va toujours du niveau d'énergie le plus élevé au niveau le plus bas. L'énergie d'activation dans cet exemple pourrait être représentée par un caillou qui tiendrait le ballon en place: ce dernier a besoin d'un léger coup de pied pour franchir cette barrière. Après la réaction se déroule spontanément.
Dans le graphique ci-haut, le niveau d'énergie initial pourrait être celui de l'hydsrogène et de l'oxygène gazeux (H2 et O2). Ces deux gaz coexistent sans problème à cause de la barrière d'énergie d'activation qui les empêche de se convertir spontanément en une molécule d'eau. il suffit cependant de l'énergie d'une étincelle pour atteindre et franchir cette barrière, et la formation de l'eau est alors si rapide et exothermique qu'elle est utilisée pour mettre la navette spatiale en orbite.
|
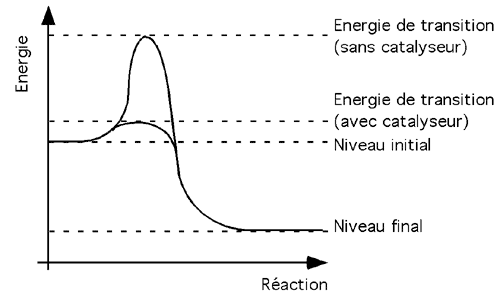
Il existe deux façons de permettre une réaction qui fait face à une barrière énergétique d'activation: fournir de l'énergie (en chauffant, par exemple) ou en utilisant un facilitateur chimique, un catalyseur. Avec un catalyseur, le niveau d'énergie d'activation d'une réaction est abaissé: celle-ci a donc moins besoin d'un apport externe d'énergie pour se dérouler. |
|
Un catalyseur peut ainsi accélérer une réaction d'un facteur de plusieurs millions de fois.
Les enzymes sont des catalystes biologiques. Ils augmentent la vitesse de réactions chimiques en en abaissant le niveau d'énergie d'activation; eux-mêmes ne sont pas affectés par la réaction proprement dite.
Enzyme + Substrat -------> Enzyme + Produit
benoit.leblanc@usherbrooke.ca

