| Retour à la page d'accueil | Section précédente | Section suivante |
3.7 Le collagène, protéine très modifiée
Consultation suggérée: Darnell, Lodish & Baltimore: Molecular Cell Biology (2nd ed). Scientific American Books, New York, 1990, pp. 906-915.
Le collagène est une protéine fibreuse insoluble de la matrice extracellulaire et du tissu conjonctif. C'est la protéine la plus abondante du règne animal. Sa famille compte jusqu'à présent 23 types de collagènes, assemblés à partir de 38 chaînes a génétiquement distinctes. (Voir le site suivant pour un exposé récent sur les différents types de collagène).
Le collagène de type I, qui nous intéresse aujourd'hui, se retrouve dans la plupart des tissus conjonctifs; il est abondant dans le derme, les os, les tendons, les ligaments et la cornée.
3.7.1 Structure primaire du collagène
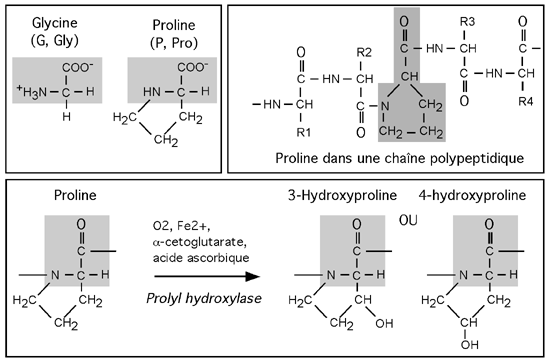
La structure primaire, ou séquence en acides aminés, du collagène est caractérisée par une très grande abondance en glycine et en proline, des acides aminés qu'on ne retrouve presque jamais dans les hélices a ou les feuillets b. Chaque 3e position dans la séquence d'une chaîne de collagène est une glycine.
|
... Gly-Pro-Met-Gly-Pro-Ser-Gly-Pro-Arg-Gly- Leu-Hyp-Gly-Pro-Hyp-Gly-Ala-Hyp-Gly-Pro-Gln-Gly- Phe-Gln-Gly-Pro-Hyp-Gly-Glu-Hyp-Gly-Glu-Hyp-Gly- Ala-Ser-Gly-Pro-Met-Gly-Pro-Arg-Gly-Pro-Hyp-Gly- Pro-Hyp-Gly-Lys-Asn-Gly-Asp-Asp... |
Séquence primaire de la chaîne a1(I) de collagène, qu'on retrouve dans le collagène de type I, du 13e au 66e acide aminé. Notez que la glycine se retrouve régulièrement tout le long de la séquence, séparée des ses voisines par deux acides aminés. Notez aussi la très grande richesse en proline et la présence d'hydroxyproline, une proline hydroxylée post-traductionnellement. |
| La glycine est un petit acide aminé. Sa chaîne latérale ne consiste en effet que d'un atome d'hydrogène. La proline est un cas spécial: sa chaîne latérale se replie et vient rejoindre son groupement aminé: la chaîne latérale dépasse alors de l'axe principal de la chaîne polypeptidique comme une anse de tasse. Cette conformation inhabituelle et rigide rend la proline incapable de participer à l'élaboration d'une hélice a. L'hydroxyproline est produite après la traduction de l'ARNm du collagène en chaîne polypeptidique: elle résulte d'une hydroxylation d'un résidu proline par l'enzyme prolyl hydroxylase, avec comme co-facteurs O2, Fe2+, l'α-cétoglutarate et l'acide ascorbique. |

|
3.7.2- Structure secondaire du collagène
|
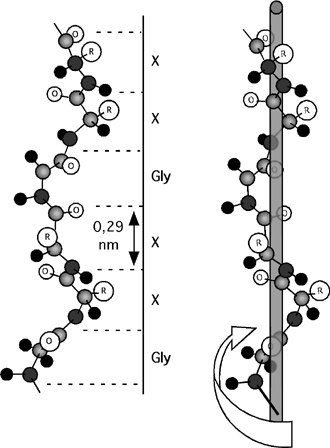
Hélice de collagène. Cette hélice est de pas gauche (elle tourne en montant dans le sens des aiguilles d'une montre). À chaque trois acides aminés on tombe sur une glycine; l'hélice est aussi très riche en proline et en hydroxyproline. Notez qu'au contraire de ce qui se passe dans une hélice α, on ne retrouve pas de ponts hydrogènes stabilisants entre les résidus d'une même hélice de collagène. L'hélice de collagène s'élève de 0,29nm par résidu et elle compte un peu moins de trois résidus par tour alors que l'hélice α ne s'élève que de 0,15nm par résidu et compte 3,6 résidus par tour. |
3.7.3 Structure quaternaire du collagène
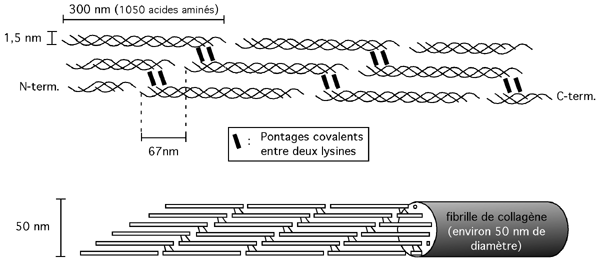
La molécule de collagène est une microfibrille consistant de trois sous-unités: trois hélices comptant chacune 1050 acides aminés et tournant l'une autour de l'autre en une super-hélice orientée dans le sens de la main droite. (L'hélice de collagène individuelle tourne dans le sens de la main gauche, mais les trois hélices tournent l'une autour de l'autre dans l'autre sens). La forme mature de cette triple hélice longue de 300nm s'appelle tropocollagène.
En plus de l'hydroxylation des prolines, on note une hydroxylation de certaines lysines (donnant des résidus d'hydroxylysine) qui serviront à stabiliser les structures supermoléculaires des microfibrilles de collagène (voir ci-dessous). Certaines de ces hydroxylysines sont O-glycosylées alors que le propetide de la partie C-terminale du procollagène est N-glycosylé. Chacune des trois chaînes, de façon concomitante à sa traduction, est transférée dans le lumen du réticulum endoplasmique. À cette étape précoce, elle consiste La région contenant la triple hélice est flanquée d'un peptide signal et d'un propeptide N-terminal, ainsi que d'un propeptide C-terminal; ces deux dernières parties aideront la maturation de la protéine.
La structure en triple hélice du tropocollagène est stabilisée par des ponts hydrogènes entre les hélices. Elle est très dépendante de la présence d'hydroxyproline. En l'absence d'hydroxyproline, la triple hélice est très instable à température de la pièce et ne se forme pratiquement pas à la température du corps. Puisque l'hydroxylation de la proline, qui a lieu dans le réticulum endoplasmique pendant la maturation du collagène, dépend de l'acide ascorbique (un cofacteur de l'enzyme prolyl hydroxylase), une carence en cette vitamine (il s'agit bien sûr de la vitamine C) conduit à une très mauvaise synthèse de collagène, ce qui conduit à la fragilité des vaisseaux sanguins, des tendons, et de la peau -les symptômes caractéristiques du scorbut. 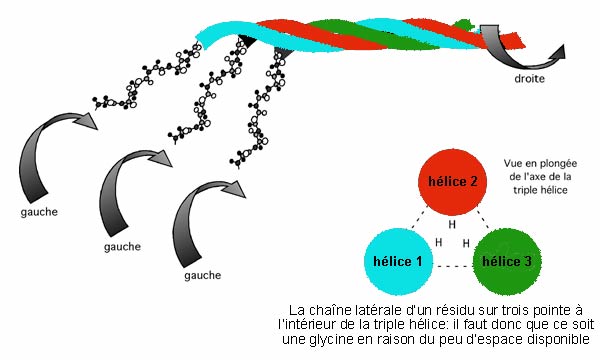
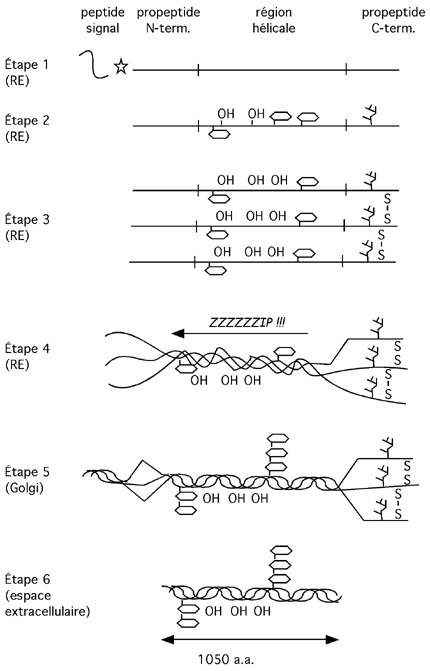
| Une fois dans le réticulum endoplasmique, le peptide signal est coupé (étape 1 de la figure ci-dessous). Ensuite, plusieurs prolines et lysines du polypeptide sont hydroxylés. Le propeptide C-terminal est modifié par N-glycosylation. Certaines hydroxylysines sont O-glycosylées (étape 2). Les différentes modifications et la formation de ponts disulfure entre les propeptides C-terminaux de trois chaînes permettent ensuite leur alignement (étape 3). Une fois sa base bien alignée, la triple hélice s'enroule alors comme une fermeture éclair, en direction du N-terminus. (étape 4). Dans l'appareil de Golgi, étape qui suit le voyage dans le réticulum endoplasmique, la triple hélice est flanquée de part et d'autre de régions non-hélicales qui ont aidé à sa maturation (étape 5). Le propeptide est alors éjecté par exocytose dans l'espace extracellulaire, où des procollagène peptidases coupent les propeptides N- et C-terminaux et libèrent une triple hélice mature de tropocollagène de 1050 a.a. ou 300 nm de longueur (étape 6). |
|
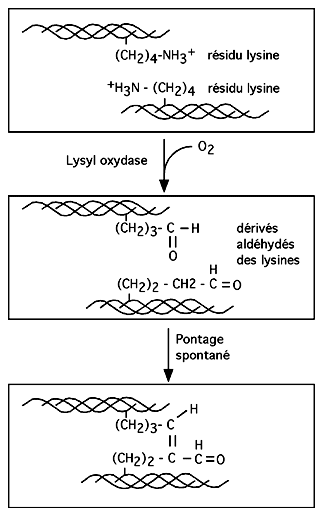
|
Les molécules de tropocollagène s'assemblent côte à côte mais avec un décallage de 67 nm. Des lysines de la partie N-terminale d'une molécule sont pontées de façon covalente à d'autres lysines de la partrie C-terminale d'une voisine par l'action de la Lysyl oxydase. |
Cela permet aux molécules de tropocollagène de s'assembler en une fibrille de 50 nm de diamètre. Ces fibrilles s'aggrègent en une fibrille d'ordre supérieur de 500nm, qui peuvent à leur tour former une fibre de collagène de 1 à 10 um de diamètre.
Tannage:
Le tannage est le processus qui permet de transformer une peau de bête en matériau imperméable et résistant à la putréfaction. Ce qui est utile dans une telle peau au point de vue structurel, c'est sa haute teneur en collagène qui la rend très solide. Pour la rendre utilisable, évidemment, il faut en tout premier lieu la débarasser de sa graisse à cause de l'odeur déplaisante qu'elle dégagerait en se dégradant; il faut aussi empêcher aussi vite que possible l'action des bactéries qui auraient tôt fait de changer la peau en vulgaire charogne.
Le dégraissage est exécuté mécaniquement, par grattage des couches adipeuses situées sous la peau. La peau est aussi salée dans un premier temps. Elle est ensuite incubée dans une substance caustique pour l'épiler. La peau est par la suite neutralisée par trempage dans un acide (des conditions basiques, en ionisant les groupements hydroxyls, empêcheraient la suite du procédé) et est rendue imperméable et résistante à la putréfaction par une incubation subséquente dans une substance appelée tannin. (De nos jours, plutôt qu'un tannin, on utilise plutôt un sel comme le sulfate de chrome).
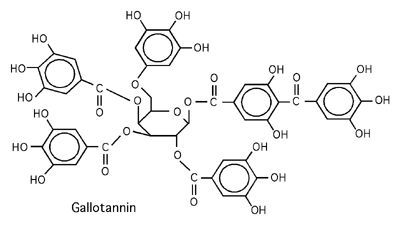
Traditionnellement, les tannins sont des polyphénols extraits de source végétale (l'écorce du chêne, de l'acacia, du bouleau, du saule, sont toutes des sources de tannins). La figure ci-bas montre la structure d'un tel tannin. Vous voyez que le nom de polyphénol n'est pas une exagération. Pendant le trempage, en s'intercalant entre les fibres de collagène, les très nombreux cycles aromatiques en chassent les molécules d'eau. Des interactions hydrophobiques entre les cycles aromatiques et les chaînes de collagène, de même que les ponts hydrogènes formés entre les très nombreux groupements hydroxyls du polyphénol avec les prolines, permettent de former un réseau très dense de fibres de collagène qui est à toutes fins utiles imperméable à l'eau. Puisque ce réseau protéique est pratiquement dépourvu d'eau, la putréfaction bactérienne ne peut y avoir lieu. Le tannage doit se faire avec une concentration pas trop élevée de tannin pour éviter que les surfaces externes du cuir ne se "ferment" trop vite, empêchant le traitement d'atteindre les couches plus profondes du cuir -qui ne serait alors pas tanné et risquerait, lui, de se dégrader avec le temps.
| Retour à la page d'accueil | Section précédente | Section suivante |