BCM-514
Biochimie des protéines
Les acides aminés
1.3 Hydrophobicité
La chaîne latérale des acides aminés peut être plus ou moins hydrophobe. Les cycles et les chaînes aliphatiques sont bien entendu plus hydrophobes que les chaînes chargées ioniquement. Ces différences joueront un rôle dans les structures supérieures des protéines. Plus un résidu est hydrophobique, plus il a tendance à se "cacher" du milieu aqueux environnant, et favorise des interactions hydrophobiques au coeur des protéines globulaires (ce qui aide à en stabiliser la structure).
Voici différentes listes du degré d'hydrophobicité des acides aminés. Comme il existe plusieurs façons d'évaluer l'hydrophobicité, on ne tranchera pas en affirmant que l'une soit meilleure que les autres.
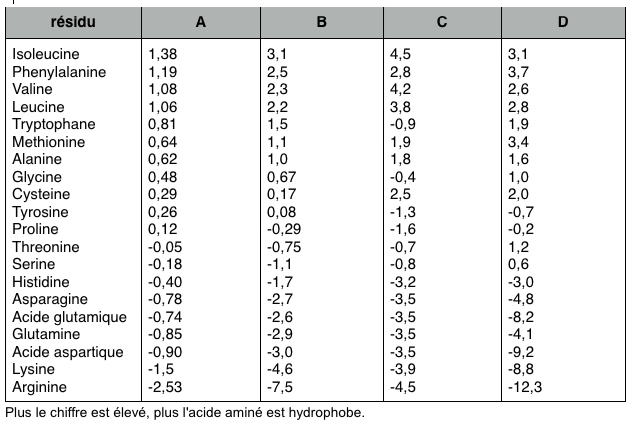
Colonne A : Cette échelle combine les résultats de cinq échelles expérimentales. Sweet & Eisenberg (1983) J. Mol. Biol. 171, 479-488.
Colonne B: Weiss et al. (1982) Faraday Symp. Chem. Soc. 17: 109-120. Les résultats sont présentés en kj/mol et représente l'énergie requise pour passer de la phase orgnique à la phase aqueuse.
Colonne C: Kyte & Doolittle (1982) J. Mol. Biol. 157, 105-132. Cette colonne est basée sur un modèle informatique pesant les valeurs d'hydrophilicité et d'hydrophobicité de chaque résidu.
Colonne D : Engleman et al. (1986) Ann. Rev. Biophys. Biophys. Chem. 15, 321-353. Cette colonne suppose que les acides aminés considérés se trouvent dans une hélice alpha de vingt résidus de longueur.
benoit.leblanc@usherbrooke.ca
