| Retour à la page d'accueil | Section précédente | Section suivante |
1.2 Charge des acides aminés
Les acides aminés individuels portent au moins deux groupes ionisables: le groupe -NH2 et le groupe -COOH, ionisables en -NH3+ et -COO-. Ils ont donc un caractère amphotère car ils peuvent être à la fois donneur ou accepteur d'électrons. Ils peuvent par conséquent servir d'agent tampon. On appelle zwitterion une molécule qui porte à la fois une charge positive et négative (c'est de l'allemand pour "ion hybride"). La nature dipolaire des acides aminés a d'abord été remarquée parce que leurs cristaux étaient beaucoup
plus stables à la chaleur que ceux de molécules organiques de taille similaire: c'est que les interactions ioniques entre les charges différentes fortifient le réseau cristallin.
Le pKa des acides aminés tourne autour de 2, ce qui est normal pour un acide; leur pKb tourne autour de 9-10, ce qui est attendu pour une base. Les chaînes latérales qui ont un pK ont des valeurs variables: le pKR de D et E tourne autour de 4 (ces chaînes sont acides); le pKR de H, R et K est de 6, 12,5 et 10,5 respectivement (ce sont des chaînes basiques). Ce qui compte en bout du compte n'est de toute façon pas tant le pK de chaque acide aminé, mais celui, global, de la protéine qui les contient!
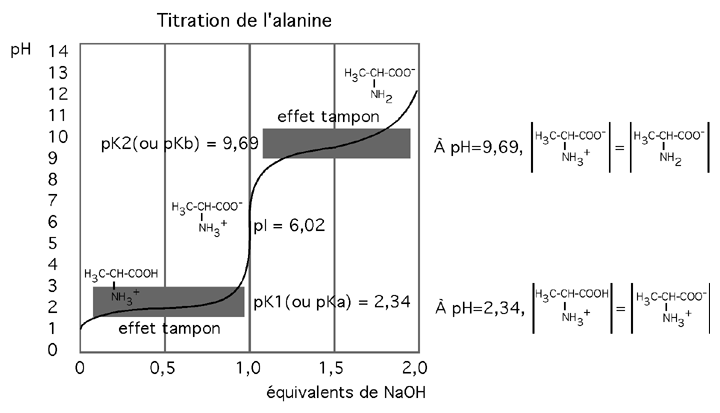
L'effet tampon des acides aminés est maximal quand le pH ambiant est près du pKa ou du pKb de la molécule, ainsi qu'on le devine en regardant la formule
pH= pKa/b + log ( [accepteur]/[donneur] )
Un effet tampon est maximal quand la concentration d'accepteur et de donneur sont similaires, ce qui donne dans la formule ci-haut un ratio proche de 1. Comme le log de 1 est zéro, pH = pKa ou pKb.
Quand toutes les charges portées par une protéines s'équivalent, on dit qu'elle atteint son point isoélectrique. C'est aussi le point où une protéine a le moins d'interactions avec les molécules d'eau, et donc le point où elle est le moins soluble.

Pour vous rappeler l'ordre dans lequel les groupes s'ionisent en fonction du pH, rappelez-vous seulement qu'à pH bas, vous ajoutez tous les hydrogènes possibles et qu'à pH élevé vous enlevez tous ceux que vous pouvez. Ainsi, à pH 2 les groupes hydroxyls seront sous forme COOH et les groupes aminés sous forme NH3+, alors qu'à pH 11 les groupes hydroxyls seront sous forme -COO- et les groupes aminés sous forme NH2.
| Acide aminé | pK1 | pK2 | pK3 | pI |
|
|
(COOH) | (NH2) | (latéral) | |
| Glycine (G, Gly) | 2,35 | 9,6 | 5,97 | |
|
|
||||
| Alanine (A, Ala) | 2,34 | 9,69 | 6,01 | |
| Valine (V, Val) | 2,32 | 9,62 | 5,97 | |
| Leucine (L, Leu) | 2,36 | 9,6 | 5,98 | |
| Isoleucine (I, Ile) | 2,36 | 9,68 | 6,02 | |
| Proline (P, Pro) | 1,99 | 10,96 | 6,48 | |
|
|
||||
| Phenylalanine (F, Phe) | 1,83 | 9,13 | 5,48 | |
| Tyrosine (Y, Tyr) | 2,2 | 9,11 | 10,07 | 5,66 |
| Tryptophane (W, Trp) | 2,38 | 9,39 | 5,89 | |
|
|
||||
| Sérine (S, Ser) | 2,21 | 9,15 | 5,68 | |
| Thréonine (T, Thr) | 2,11 | 9,62 | 5,87 | |
| Asparagine (N, Asn) | 2,02 | 8,08 | 5,41 | |
| Glutamine (Q, Gln) | 2,17 | 9,13 | 5,65 | |
|
|
||||
| Cystéine (C, Cys) | 1,96 | 8,18 | 10,28 | 5,07 |
| Methionine (M, Met) | 2,28 | 9,21 | 5,74 | |
|
|
||||
| Acide aspartique (D, Asp) | 2,19 | 9,6 | 3,65 | 2,77 |
| Acide glutamique (E, Glu) | 2,19 | 9,67 | 4,25 | 3,22 |
|
|
||||
| Histidine (H, His) | 1,82 | 9,17 | 6 | 7,59 |
| Lysine (K, Lys) | 2,18 | 8,95 | 10,53 | 9,74 |
| Arginine (R, Arg) | 2,17 | 9,04 | 12,48 | 10,8 |
| Retour à la page d'accueil | Section précédente | Section suivante |