| Retour à la page d'accueil | Section précédente | Section suivante |
3.4 Ajouts de glucides, simples ou complexes
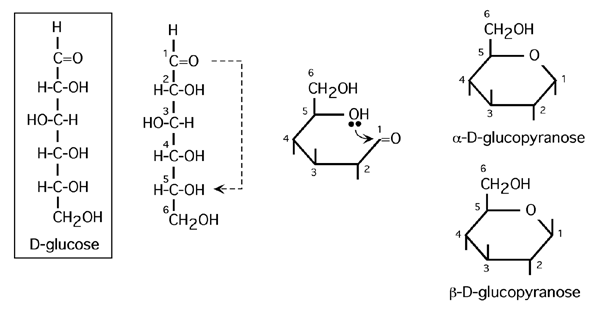
3.4.2 Structure pyranosique

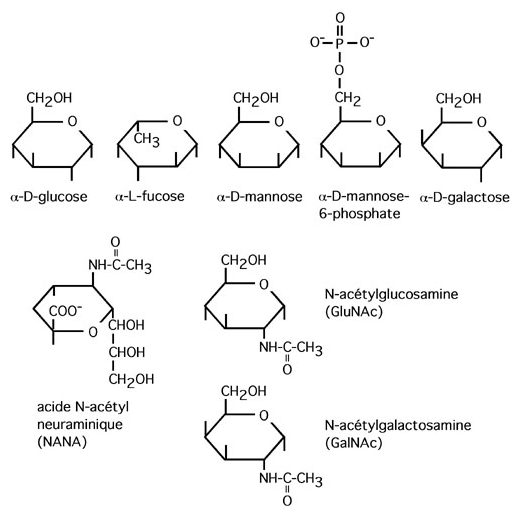
3.4.4 Glycosylation en N et en O
Liées en N: sucres ancrés sur l'azote du groupement amide de l'asparagine. Le sucre qui contacte l'asparagine est le N-acetylglucosamine (GlcNAc).
Les structures liées en N ou en O sont très différentes. Les chaînes liées en O sont plus courtes et plus variables que celles en N, et ne contiennent la plupart du temps qu'un, deux ou trois résidus glucidiques. Les chaînes en N peuvent former de véritables arborisations.
Le site d'attachement des chaînes liées en N a un consensus N-X-S(T), où X peut être n'importe quel acide aminé sauf la proline. Les chaînes liées en N contiennent toutes une structure de base consistant en deux GlcNAc et trois mannoses; sur cette structure viennent se greffer d'autres glucides.
Selon la nature de ces autres glucides, on divise les arborisations glucidiques liées en N en trois familles:
- Type riche en mannose, qui ne contient que des résidus mannose en plus de la structure de base;
La plupart des protéines sécrétées ou attachées à la membrane plasmique sont glycosylées.
Les glycoprotéines sont composées de protéines liées de façon covalente à des sucres, qui peuvent contribuer à leur stabilité, leur adressage, leur solubilité ou faciliter l'adoption d'une structure (ce qui est le cas du trimère d'hémagglutinine du virus de l'influenza, permettant à ce pathogène de fusionner avec la membrane de sa cellule-cible).
Le sucre situé le plus à l'extérieur d'une chaîne glucidique liée à une protéine est souvent l'acide N-acétylneuraminique, chargé négativement, qui aide à tenir les protéines éloignées les unes des autres (par répulsion de charges).
La glycosylation des protéines est présente dans toutes les cellules eucaryotes. Elle se retrouve aussi chez les bactéries, une découverte assez récente d'ailleurs. La majeure partie des glycoprotéines se trouve sur la face externe de la membrane plasmique, avec la partie glycosylée pendouillant dans le milieu extracellulaire; il existe cependant aussi des glycoprotéines intracellulaires, comme les facteurs de trannscription SP1ou YY1 qui sont O-glycosylés par le N-acétylglucosamine.
Les chaînes glucidiques des glycoprotéines sont dites liées en N ou en O selon leur site d'ancrage.
Liées en O: sucres ancrés sur l'oxygène du groupement hydroxyl de
la sérine,
la thréonine,
l'hydroxylysine (dans le collagène).
Le sucre accroché à la sérine ou la thréonine est GalNAc. Le sucre accroché à l'hydroxylysine est le galactose.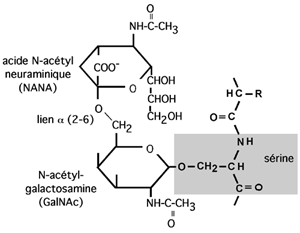
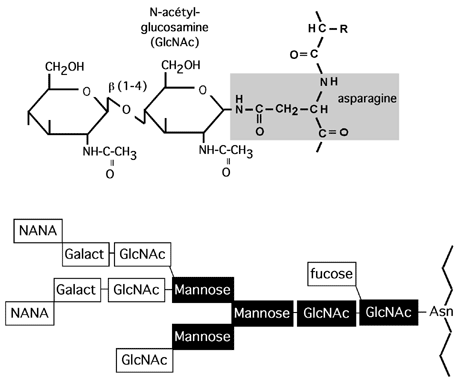
- Type hybride, qui contient différents sucres et sucres aminés;
- Type complexe, qui ressemble au type hybride mais contient aussi du NANA.
la glycosylation en N commence en même temps que la traduction, dans le lumen du réticulum endoplasmique, et se continue jusque dans le Golgi. L'attachement de sucres en O se fait dans le Golgi, grâce à l'action de glycoprotéines glycosyltransférases.
Liaison en N: ce type de glycosylation requiert un intermédiaire, le dolichol phosphate. Ce polymère hydrophobe est inséré dans la membrane et est relié par un groupe diphosphate au précurseur glucidique de l'arborisation liée en N. (Même si la structure et la composition finale de cette chaîne glucidique change d'une protéine à l'autre, le précurseur est toujours le même).
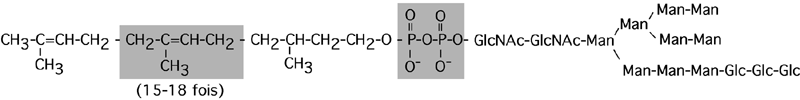
Lorsque le polypeptide portant un signal N-X-S(T) entre dans la lumière du réticulum endoplasmique, une oligosaccharide protéine transférase décroche la chaîne glucidique du dolichol et la greffe sur l'asparagine-cible.
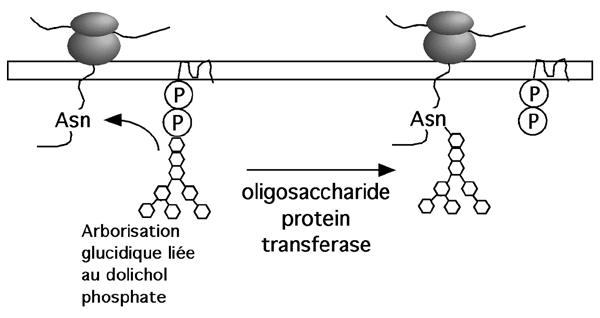
La chaîne glucidique n'est pas au bout de ses peines, cependant: elle continue d'être modifiée dans le réticulum et dans le Golgi.
On peut inhiber la glycosylation des protéines. La tunicamycine, par exemple, est un agent inhibiteur de la N-glycosylation. Elle empêche la glycosylation du résidu Asn initial. Elle arrête en plus le cycle cellulaire en G1.
Liaison en O: Ici, les résidus sont ajoutés un par un (s'il y en a plus d'un). Les sucres ajoutés sont sous forme "activée", c'est à dire liés à un nucléotide, et les glycoprotéines transférases les ajoutent directement sur les acides aminés cibles.
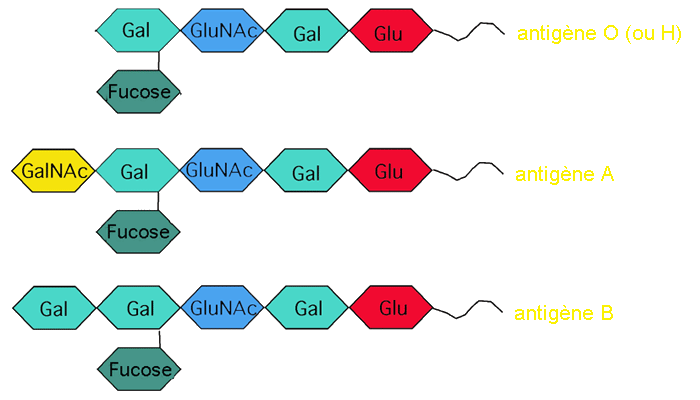
Les groupes sanguins ABO résultent d'une glycosylation effectuée avec les mêmes enzymes que pour la O-glycosylation, même s'ils ne sont pas toujours associés à des protéines. Ils viennent de ce que trois conformations possibles d'un oligosaccharide greffé sur une protéine membranaire des globules rouges donnent naissance à trois antigènes: l'antigène H (ou O), l'antigène A et l'antigène B.
Ces épitopes, A, B et O, sont entièrement glycosidiques: ils peuvent être portés par une glycoprotéine (comme la bande 3, la bande 4.5 ou d'autres) ou même par un lipide. La bande 3 contient aussi une unique chaîne glycosylée liée en N, pointant vers l'extérieur de la cellule, et qui porte elle-même plus de la moitié des épitopes antigéniques du système ABO.
Ces épitopes, A, B et O, sont entièrement glycosidiques: ils peuvent être portés par une glycoprotéine (comme la bande 3, la bande 4.5 ou d'autres) ou même par un lipide. La bande 3 contient aussi une unique chaîne glycosylée liée en N, pointant vers l'extérieur de la cellule, et qui porte plus de la moitié des épitopes antigéniques du système ABO.
L'épitope "de base" du système ABO consiste à la base d'un groupe de cinq sucres: le glucose, le galactose, le N-acétylglucosamine, le galactose et le fucose. Ces sucres constituent l'antigène O (ou H) qui est -théoriquement- partagé par tout le monde.
Chez les individus de type A, on retrouve un enzyme (la Fucosylglycoprotein alpha-n-acetylgalactosaminyltransferase EC 2.4.1.40 ) qui ajoute un N-acétylgalactosamine à l'a ntigène O. Chez les individus de type B, on retrouve un autre enzyme (la Fucosylglycoprotein 3-alpha-galactosyltransferase EC 2.4.1.37) qui ajoute un galactose à la place. Les individus qui possèdent une allèle de chaque type pour ces enzymes ont des cellules portant un antigène A et un antigène B, et ils sont dits AB (puisque leur système immunitaire a appris à n'attaquer ni l'une ni l'autre des deux formes A et B). Les individus dépourvus des deux enzymes sont de type O, et leur système immunitaire attaque les antigènes A et B.
Il existe une mutation empêchant la synthèse de l'antigène O (le fucose manque); les individus porteurs de cette mutation sont dits appartenir au groupe de Bombay. Comme les tests pour déterminer les groupes sanguins sont basés sur une reconnaissance immunitaire (le sang de type A réagit avec les anticorps anti-A, le sang de type B réagit avec les anticorps anti-B, le sang de type AB réagit les deux alors que le sang O ne réagit pas du tout), le sang du type de Bombay peut passer pour du sang O (puisqu'il ne réagit ni avec A ni avec B). Ces individus sont donc passibles de recevoir une transfusion qui peut leur être fatale.
Pour échapper à une réponse immunitaire trop sévère de son hôte (l'être humain, par exemple), la bactérie entérique Shigella flexneri est équipée d'une structure lipopolysaccharidique qui contient plusieurs répétitions de l'antigène O. Ce polymère d'antigène O s'étend bien au-delà de la surface de la bactérie.
3.4.6 Adressage par le biais d'une glycosylation
Les protéines destinées à l'exportation où à certains compartiments dans la cellule ne sont pas traduites dans le cytosol mais dans la lumière du réticulum endoplasmique, à la surface duquel les ribosomes sont attachés et lui donnent un aspect rugueux en microscopie électronique. Les protéines qui entrent dans le RE doivent ensuite être acheminées vers leur destination correcte.
| Les enzymes qui doivent se rendre dans les lysosomes y sont dirigés par une glycosylation spécifique: ils portent un mannose-6-phosphate. Le phosphate est ajouté à la protéine (qui est déjà une glycoprotéine, bien entendu) selon le processus décrit dans la figure qui suit. Cette réaction se produit dans le Golgi. |
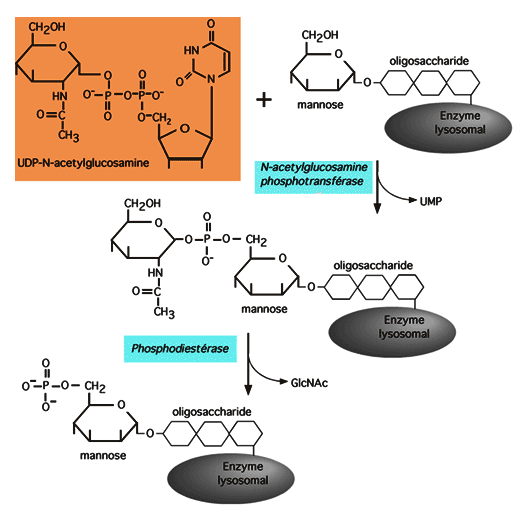
|
Deux récepteurs de mannose-6-phosphate sont présents sur la membrane interne de l'appareil de Golgi et permettent de diriger les protéines vers les lysosomes.
3.4.7 Glycosylation et infection
Beaucoup de virus et d'autres agents pathogènes ont évolué de façon à reconnaître les sucres présents à la surface des cellules et s'en servent comme points d'arrimage.
- Le virus VIH entrent dans les cellules du système immunitaire en s'attachant à des récepteurs tels CXCR4 et CXCR5, qui sont des glycoprotéines.
- La glycoprotéine membranaire Dystroglycan est une composante du complexe de la dystrophine. Deux protéines sont issues du gène de dystroglycan (suite à une maturation enzymatique): a-DG et b-DG. Le a-DG présent sur les cellules de Schwann est le récepteur de Mycobacterium leprae, ainsi que des arénavirus (causant des fièvres hémorrhagiques, telle la fièvre de Lhassa).
- Les rhinovirus (qui causent le rhume) utilisent la glycoprotéine ICAM-1 comme point d'entrée.
- Le virus de la rage se lie à la glycoprotéine N-CAM.
- L'agent malarial Plasmodium vivax utilise le récepteur de l'interleukine 8 pour entrer dans les érythrocytes.
- Plasmodium falciparum, lui, utilise les sucres portés par la glycophorine à la surface des éryhtrocytes. G. La glycophorine sert aussi de point d'entrée pour le virus de l'influenza. (Les sucres de la glycophorine contribuent à établir le système de groupe sanguin dit MNS:ce sont des antigènes propres à l'être humain mais attaqués par le système immunitaire d'autres animaux).
| Retour à la page d'accueil | Section précédente | Section suivante |