BCM-514
Biochimie des protéines
3.0 Modifications post-traductionnelles
3.3 Ajout d'acides gras ou de composés hydrophobiques.
Qu'il s'agisse d'une chaîne organique hydrophobique, d'un acide gras simple ou d'un complexe glycophosphatidylinositol, on retrouve de nombreuses "ancres" qui permettent à des protéines de rester attachées aux membranes biologiques. Cette section décrit les principales:
(a) le GLI, ou glycosylphosphatidylinositol;
(b) les composés isoprénoïdes que sont le farnesol et le géranylgéranol;
(c) les acides palmitiques et myristoïques.
Nous parlerons aussi du cholestérol, même s'il ne s'agit pas d'un ajout fréquent.
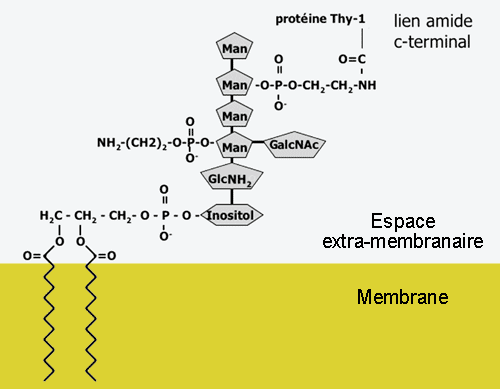
3.3.1 Glypiation, ou ajout de GLI
Le nom de glypiation vient de GLYcosyl Phosphatidyl Inositol. Il s'agit d'une modification rare en général, mais qui se retrouve dans plusieurs protéines ancrée dans la membrane par un acide gras couplé à leur extrémité C-terminale. La molécule entière pourrait avoir la structure suivante:
|
(N- PROTÉINE -C) - phosphoethanolamine- mannose- glucosamine- phosphatidylinositol- (phospholipides)
mais la nature de la chaîne liant le PI à la protéine peut varier et compter de nombreux sucres. De telles protéines n'ont pas de domaine transmembranaire et sont exclusivement trouvées à la surface des cellules.
Les protéines avec une ancre GPI se divisent en enzymes, marqueurs, molécules d'attachement et en protéines de transport non-catalytiques. La protéine PrPc, le précurseur de la protéine PrPsc associée à la maladie de la vache folle, possède une telle ancre de GPI.
Vous voyez ici l'ancre de GPI de la protéine neuronale Thy-1.
|
|
L'ancre de GPI est préformée et est ancrée dans la membrane. Elle est ajoutée à une protéine en remplaçant une des extrémités de la chaîne; c'est à dire qu'une partie de la protéine est perdue quand l'ancre est ajoutée. La cible du GPI sur la protéine est une séquence de 3-5 petits acides aminés suivis de 8-12 acides aminés hydrophiles, puis de 8-20 acides aminés hydrophobes; l'ancre de GPI s'intercale entre les petits acides aminés et les aa hydrophiles.
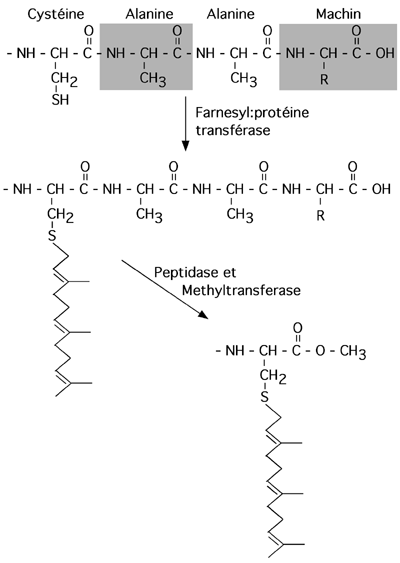
3.3.2 Isoprénylation ou prénylation
Liaison entre un résidu cystéine C-terminal et l'un de deux composés poly-isoprènes,

|

|
|
le farnésyl-diphosphate
|
ou le géranylgéranyldiphosphate
|
L'isoprénylation permet à des protéines de se fixer dans une membrane. C'est le cas des protéines G impliquées dans la transduction du signal. Les membres de la famille Ras s'accrochent aussi à la membrane plasmique par une ancre farnésylée. En plus, N-Ras, K-RASA sont palmitoylés une fois et H-Ras l'est deux fois.
|
L'ajout d'un groupement isoprénoïde à une protéine se fait sur une séquence cible CAAX, où C est une cystéine, A représente un acide aminé aliphatique et X est Ser, Met, Ala ou Glu. (On retrouve aussi parfois des cibles Cys-Cys ou Cys-X-Cys, selon la farnesyl transférase impliquée dans la réaction).
L'ajout du groupement se fait sur le -SH de la cystéine de la séquence cible; par la suite, la protéine est coupée juste après cette cystéine et un groupement méthyl y est ajouté à l'extrémité C-terminale.
L'ajout du groupement se fait sur le -SH de la cystéine de la séquence cible; par la suite, la protéine est coupée juste après cette cystéine et un groupement méthyl y est ajouté à l'extrémité C-terminale.
On a dit que la farnésylation permet à la protéine Ras de se positionner dans la membrane; c'est pourquoi plusieurs drogues anticancéreuses en voie de développement sont des inhibiteurs de farnesyltransférase, qui empêchent Ras de se retrouver à la membrane et de véhiculer les signaux extracellulaires pro-mitotiques.
|
|
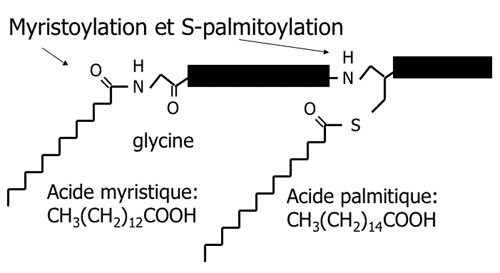
3.3.3 Palmitoylation et myristoylation
Les deux acides gras les plus souvents ajoutés aux protéines sont l'acide palmitique et l'acide myristique.

Ils servent eux aussi à ancrer les protéines dans une membrane, et parfois à les diriger vers le bon compartiment cellulaire.
|
La liaison entre une cystéine interne et un acide gras est une S-acylation; ce lien peut être renversé à cause de la fragilité de la liaison thioester (sensible à la réduction). Une liaison ester simple entre un acide gras et une sérine interne (O-acylation) est aussi parfois observée.
L'acide myristique peut aussi se retrouver dans une position particulière: sur une glycine localisée à l'extrémité N-terminale d'une protéine. C'est une modification courante des protéines membranaires virales. La myristoylation N-terminale n'est pas réversible. La protéine gag de HIV est ainsi myristoylée; sans cette modification, le virus ne peut pas produire de particules infectieuses.
|
|
La protéine BID impliquée dans l'apoptose est un exemple de transit intracellulaire régulé par la myristoylation: pour participer à la réponse apoptotique, BID doit être localisé sur la membrane de la mitochondrie. Or, sa forme inactive reste bêtement dans le cytoplasme. Lors du déclenchement de la réponse apoptotique, la caspase 8 vient couper BID en deux morceaux, p7 et p15, qui restent cependant associés par une interaction hydrophobes. Cependant, même si les deux morceaux restent collés, l'extrémité N-terminale fraîchement coupée de p15 est maintenant GSQSAR, et cette glycine N-terminale est une cible pour les enzymes qui transfèrent l'acide myristique. p15 se fait myristoyler, et cette nouvelle ancre d'acide myristique permet de diriger le BID activé vers la membrane de la mitochondrie.
Même des protéines possédant des domaines transmembranaires peuvent utiliser une ancre hydrophobique pour arrimer une partie hydrophilique de leur structure à la membrane: c'est le cas de la rhodopsine, qui même si elle possède sept domaines transmembranaires utilise quand même une ancre S-palmitoylée pour attacher son extrémité C-terminale (cytoplasmique et hydrophile) à la membrane plasmique.
benoit.leblanc@usherbrooke.ca





