
| Retour à la page d'accueil | Section précédente | Section suivante |
Après avoir choisi une source de matériel et sélectionné une technique d'extraction, vous voici arrivé à l'étape de la séparation des protéines et de l'enrichissement de celle que vous voulez purifier.
De façon générale, les premières étapes d'une séparation protéique sont des techniques peu coûteuses et à capacité élevée. Les techniques demandant des réactifs plus onéreux (des anticorps, par exemple) sont d'habitude gardées pour plus tard, quand il y a moins de matériel total et une plus grande proportion relative du matériel qui nous intéresse.
5.6.1 Précipitation différentielle au sulfate d'ammonium
Cette technique utilise la solubilité différentielle des protéines. Comme chaque protéine est plus ou moins soluble en solution selon sa composition, on peut en séparer plusieurs en fonction de leur tendance à précipiter plus ou moins vite quand on change la force ionique de la solution qui les contient.
Une force ionique élevée peut avoir deux effets sur la solubilité: neutraliser certaines charges ioniques requises en surface pour le maintien de la solubilité, et compétitionner avec les protéines pour les molécules d'eau disponibles en solution. Quand la concentration en sel est assez élevée pour priver une protéine des molécules d'eau qui l'hydratent, celle-ci sort de solution et précipite. C'est ce qu'on appelle le phénomène de salting-out.
Les protéines seront éventuellement toutes précipitées par une teneur en sel assez élevée, mais certaines d'entre elles seront remarquablement résistantes alors que d'autres précipiteront très facilement. C'est cette différence de solubilité qui permet de les séparer.
La série de Hofmeister ci-dessous décrit les effets relatifs de différents ions sur la précipitation des protéines ou la promotion de leurs interactions hydrophobiques. (L'anion phosphate et le cation ammonium sont est les plus efficaces pour précipiter les protéines; l'anion chlorate et le cation Ca2+ sont au contraire les plus efficaces pour les remettre en solution. Notez que ce ne sont pas toutes les combinaisons de ces ions qui donnent un sel soluble).
|
précipitation (salting out) |
PO43- > SO42- > COO- > Cl- > Br- > NO3- > ClO4- |
chaotropique (salting in) |
|
NH4+ > Rb+ > K+ > Na+ > Cs+ > Li+ > Mg2+ > Ca2+ |
Le sel le plus utilisé en laboratoire pour précipiter les protéines est le sulfate d'ammonium (NH4)2SO4. Sa solubilisation n'affecte pas la température de la solution (au contraire du NaCl, dont la solubilisation exothermique aide à faire fondre la glace dans les rues l'hiver), il ne dénature pas les protéines et ne coûte pas cher.
Le tableau ci-dessous donne les quantités de (NH4)2SO4 requises pour atteindre le niveau de saturation à 0°C. (Le tableau indique aussi combien de sel ajouter à une solution qui en contient déjà).

La procédure suivie d'habitude quand on travaille en aveugle est de préparer quelques précipitats avec des concentrations croissantes de sulfate (qu'on peut ajouter directement à la solution protéique):
|
(1) Ajustement à 20% sulfate |
Centrifugation et récupération du culot (fraction C20) |
|
(2) Ajustement du surnageant à 40% sulfate |
Centrifugation et récupération du culot (fraction C40) |
|
(3) Ajustement du surnageant à 60% sulfate |
Centrifugation et récupération du culot (fraction C60) |
|
(4) Ajustement du surnageant à 80% sulfate |
Centrifugation et récupération du culot (fraction C80) |
|
(5) Ajustement du surnageant à 100% sulfate |
Centrifugation et récupération du culot (fraction C100) |
Notre protéine se trouvera dans une des fractions C20, C40, C60, C80 ou C100.
Bien sûr, si on sait à l'avance comment notre protéine réagit au salting-out, on peut viser avec plus de précision. Si elle précipite à environ 35% sulfate, on fera une première coupure avec 30% sulfate, une deuxième à 40% sulfate, et une dernière (juste au cas) à une teneur en sel plus élevée. Mais nous saurons déjà que notre protéine se trouve dans la fraction C40, et qu'elle est débarassée de tout ce qui précipite en-deçà de 30% sulfate et au-delà de 40%.
Les culots de protéines peuvent alors être resuspendus. Ils contiendront cependant encore une grande quantité de sulfate dont il faut se débarasser.
5.6.2 Dialyse
La méthode la plus utilisée pour changer la concentration en sels d'une solution protéique est la dialyse. Dans une dialyse, les protéines dans une concentration de sels donnée sont séparées d'une solution à la concentration en sels différente par une membrane poreuse. Les pores de cette membrane peuvent avoir différentes tailles; certaines membranes ne laisseront passer que des ions alors que d'autres laisseront même passer de petites protéines (jusqu'à des poids moléculaires de 50 000 Da).
Les sels auront tendance à équilibrer leur concentration de part et d'autre de la membrane. En utilisant un volume de tampon de dialyse beaucoup plus grand que celui de la solution protéique, on changera rapidement la teneur en sels de celle-ci en la même que celle du tampon de dialyse.
Afin d'accélérer le processus, il vaut mieux changer souvent le tampon de dialyse pour du tampon neuf plutôt que d'utiliser une seule quantité (même grande) de tampon. Voyez plutôt: puisque C1V1=C2V2, la dialyse de 10mL de solution protéique à 500mM dans 1000mL de tampon de dialyse à 100mM donnera une concentration de 104 mM à l'équilibre.
(500mM x 10 mL) + (100mM x 1000mL) = 1010 mL x 104mM
On aurait pu atteindre la même concentration en dialysant dans un plus petit volume et en changeant le tampon une fois:
dialysat protéique tampon dialyse équilibre
1) (500mM x 10mL) + (100mM x 100mL) = 110mL x 136 mM
2) (136mM x 10mL) + (100mM x 100mL) = 110mL x 103 mM
La vitesse de dialyse dépend beaucoup de la quantité de matériel à dialyser et de la viscosité des solutions.
Notez que l'eau sera la première à diffuser: il n'est pas rare de voir un tube de dialyse gonfler progressivement alors que l'eau y pénètre pour en réduire la concentration en solutés. Attention aux éclatements.
À l'inverse, on peut utiliser des agents hygroscopiques pour concentrer les protéines dans un sac à dialyse sans en changer la concentration en sels: il faut alors utiliser un tampon de dialyse de même composition que le tampon se trouvant dans le tube, mais contenant un agent comme le polyethylèneglycol (ou PEG, un gros polymère hygroscopique) de taille supérieure à la porosité de la membrane. Le PEG ne pourra pas entrer dans le tube mais il attirera l'eau qui s'y trouve hors du tube, concentrant du même coup les protéines.
5.6.3 Filtration sur membrane
Je la mentionne ici parce qu'elle peut être utilisée pour changer la salinité d'une solution de protéines, mais en fait la filtration sur membrane se prête beaucoup mieux à une étape tardive de la purification qu'au début des opérations.
On y utilise des membranes avec une porosité permettant à certaines substances de passer (sels, petites molécules, petites protéines). Ces membranes sont le plus souvent vendues sous forme d'unités de filtration (vous en avez peut-être déjà rencontrées sous le nom de colonne Centricon),
qui consistent en un tube dont la partie inférieure est séparée de la partie supérieure par la membrane. Les protéines sont déposées dans la partie supérieure du tube, et reposent sur la membrane; le tube est alors centrifugé à basse vitesse pour forcer le liquide et les petites molécules à traverser cette dernière sous le coup de la gravité. Les protéines, trop grosses, ne peuvent pas passer et restent dans la partie supérieure; on peut ensuite soit les diluer avec un nouveau tampon et recentrifuger (c'est une bonne technique de lavage) ou récupérer les protéines concentrées.
Il faut bien sûr ne pas centrifuger si longtemps que tout le liquide ait traversé la membrane.
![]()
5.6.4 Sédimentation
Vous trouverez beaucoup d'informations sur les principes de la sédimentation à cette adresse:
http://ntri.tamuk.edu/centrifuge/centrifugation.htmlLes protéines ont un coefficient de sédimentation défini par leur taille, leur forme et leur densité. On peut donc les séparer par ultracentrifugation sur des coussins ou des gradients de sucrose ou d'autres substances.
Dans une centrifugation zonale, l'échantillon est déposé en une mince bande au sommet d'un tube contenant un tampon présentant un gradient de densité. Les protéines s'enfonceront et se sépareront dans le gradient en fonction de leur coefficient de sédimentation (les plus lourdes et denses coulent plus vite). Comme toutes les protéines finiront par arriver au fond du tube, il faut arrêter la centrifugation avant, puis séparer chaque "étage" du tube (en fait, on fractionne le contenu du tube en en retirant des volumes égaux à partir du sommet).
Dans ce type de centrifugation, la densité du matériel à séparer excède celle du matériel du gradient. C'est ce qui permet aux particules de s'y enfoncer sans s'arrêter en cours de route.
Ce genre de séparation est particulièrement approprié pour la préparation de gros complexes protéiques qui sédimenteront beaucoup plus vite que leurs composantes individuelles. C'est une des excellenetes façons d'exploiter à notre profit la taille de telles complexes sans nécessairement avoir recours à une technique de filtration. Les ARN polymérases eucaryotes ou les facteurs de transcription complexes comme TFIIH se prêtent particulièrement bien à la purification par fractionnement sur gradient.
Dans une centrifugation isopycnique, maintenant, le gradient de densité couvre un spectre qui inclue la densité de toutes les particules à séparer. Le matériel "flottera" alors dans le gradient à un niveau où sa densité est égale à celle du milieu ambiant.
L'ADN a longtemps été préparé sur des gradients isopycniques de chlorure de césium. On peut aussi séparer les protéines sur CsCl. (Le CsCl forme spontanément un gradient dans un tube quand il est centrifugé à haute vitesse pendant 24-48hrs parce que les atomes lourds Cs+ ont tendance à decendre au fond). Comme ce gradient se forme spontanément, les particules à séparer peuvent être mélangées directment au CsCl avant la mise en tube: l'établissement du gradient de CsCl et la séparation isopycnique des particules se feront en même temps pendant la centrifugation.
Le Percoll, une substance développée par Amersham Biocsciences, est une suspension de billes de silice couvertes de polyvynipyrrolidone. Comme les billes ont une taille hétérogène, le Percoll peut lui aussi spontanément former un gradient quand il est centrifugé assez longtemps, On s'en sert pour la séparation isopycnique d'organelles cellulaires ou de virus.
Il est possible de préparer une centrifugation isopycnique avec un gradient préparé à l'avance: il faut alors s'assurer de ce que la partie la plus dense du gradient excède la densité du matériel que l'on veut voir se stabiliser dans sa migration en fonction de sa densité propre.
On a souvent recours à un type de gradient isopycnique utilisant un gradient discontinu de sucrose: un coussin à haute teneur en sucrose (mettons 80%) se trouvera dans le fond du tube, avec un coussin de 50% par dessus, puis un coussin de 25%, puis un coussin de 10%. Les particules qui traversent un coussin pourraient être arrêtées à la surface du suivant.
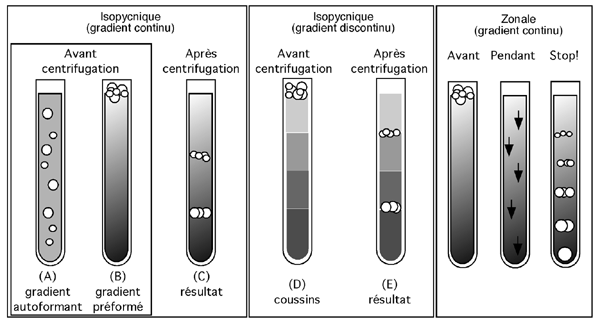
Différents types de gradients permettant la séparation de particules en fonction de leur densité
5.6.5 Filtration sur gel
Il s'agit ici d'une séparation des protéines selon leur taille utilisant un tamis moléculaire. Une colonne de chromatographie pour filtration sur gel est remplie d'une résine consistant en billes creuses et poreuses. La taille des pores de ces billes est telle que certaines protéines (petites) peuvent entrer et sortir à leur guise; que certaines (plus ou moins grosses) peuvent essayer d'entrer mais avec plus ou moins de succès, alors que d'autres (trop grosses) ne peuvent pas entrer du tout et passent tout droit.
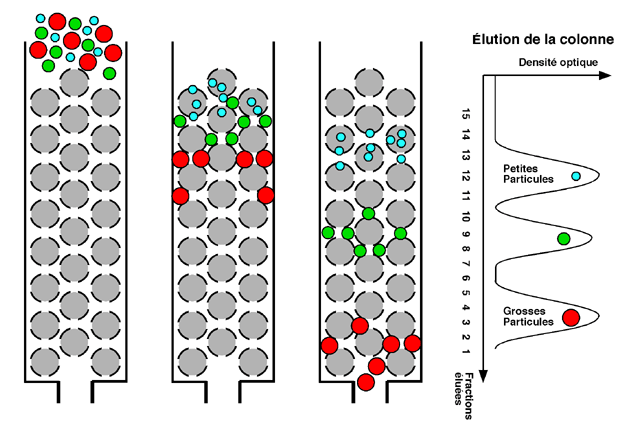
Les plus grosses protéines, celles qui passent carrément entre les billes, sortent en premier de la colonne. Les autres sont retardées par leurs interactions avec les billes; les plus petites protéines, qui peuvent entrer et sortir à leur guise, sont les dernières à quitter la colonne.
|
Nom de la résine |
Capacité de fractionnement (en Da) |
|
type dextran |
|
|
Sephadex G-10 |
700 |
|
Sephadex G-25 |
1 000- 5 000 |
|
Sephadex G-75 |
3 000- 70 000 |
|
Sephadex G-200 |
5 000- 800 000 |
|
type polyacrylamide |
|
|
Bio-gel P2 |
200- 2 000 |
|
Bio-gel P6 |
1 000- 6 000 |
|
Bio-gel P-150 |
15 000- 150 000 |
|
Bio-gel P-300 |
60 000- 400 000 |
|
type agarose |
|
|
Sepharose 2B |
2 000 000- 25 000 000 |
|
Sepharose 4B |
300 000- 3 000 000 |
|
Bio-gel A-0,5M |
30 000- 500 000 |
|
Bio-gel A-15M |
30 000- 15 000 000 |
|
Bio-gel A-150M |
5 000 000- 150 000 000 |
Cette technique est très efficace mais nécessite une haute concentration et un faible volume de matériel de départ parce que les protéines ont tendance à s'étaler le long de la colonne, ce qui réduit la qualité de leur séparation si elle n'y entrent pas relativement toutes en même temps.
Cette colonne peut aussi être utilisée pour dessaler un échantillon.
La forme d'une colonne de filtration devrait être étroite et longue pour une meilleure séparation.
La filtration sur gel se fait avec un tampon dont la nature ne change pas pendant la séparation, à l'inverse de ce qui se passe dans une chromatographie d'échange d'ions. Les protéines assemblées en complexes macromoléculaires (comme par exemple les ARN polymérases, qui comptent un grand nombre de sous-unités) ont donc plus de chances de rester assemblées, puisqu'on n'interfère pas avec les interactions entre les différentes sous-unités.
5.6.6 Échange d'ions
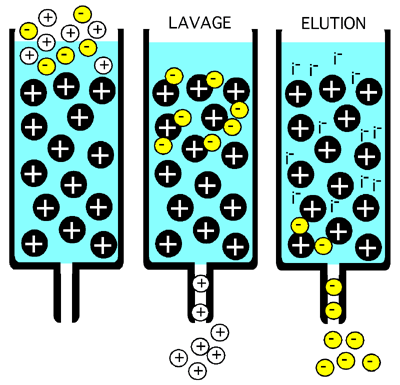
Dans une colonne à échange d'ions, les protéines collent par affinité électrostatique à des groupements chargés de la résine. Une résine portant des groupements positifs est dite "échangeuse d'anions", parce que des ions négatifs ou les groupements acides d'une protéine peuvent interagir avec. Une résine portant des groupements négatifs est dite "échangeuse de cations" parce que ce sont des cations ou les groupements basiques d'une protéine qui interagissent avec elle.
On fera décoller les protéines d'une telle résine en augmentant progressivement la force ionique du tampon d'élution, ou en changeant le pH de telle façon que la protéine soit moins chargée. Un gradient salin permet de séparer les protéines selon leur degré de charge positive ou négative à un certain pH et est une étape de choix dans une purification.
On peut même effectuer les deux types de chromatographie d'échange d'ions, car une même protéine aura souvent des charges positives et des charges négatives distribuées de façon inégale. À l'inverse de ce qui se passe en électrophorèse, ici, ce n'est pas la charge nette de la protéine qui compte mais la capacité de ses résidus chargés d'interagir avec la résine.
Comme on veut favoriser l'interaction de la protéine avec la résine choisie, on aura avantage à jouer avec le pH de la solution tampon qui circule dans la colonne. Pour une résine échangeuse de cations (monoS ou phosphocellulose, par exemple), on voudra optimiser la charge positive de la protéine et donc travailler à un pH plus bas, histoire de bien former des groupements -NH3+ et -COOH plutôt que -NH2 et -COO-. Un tampon HEPES à pH 7,5 serait approprié. À l'inverse, pour une résine échangeuse d'anions (monoQ ou DEAE), on utilisera plutôt un tampon basique comme le Tris à pH 8,2, histoire de favoriser la formation de groupements -COO- et de réduire la présence de groupements NH3+.
La résine n'a pas à être utilisée en colonne. On peut la mettre au fond d'un bécher et y ajouter la solution de protéine (ce qui est pratique dans les premières étapes d'une purification si on a de très grands volumes de matériel). On peut aussi ménager la chèvre et le chou et mettre les protéines en contact avec la résine dans un bécher ou un tube, effectuer des lavages à faible force ionique dans le même récipient, puis déposer la résine dans une colonne vide pour procéder à une élution plus contôlée.
Il existe une très grande variété de résines échangeuses d'ions, variant les groupes chargés comme la nature des supports solides. Des colonnes pré-empaquetées sont aussi disponibles et sauvent un temps précieux. Le catalogue Amersham Biosciences www.amersham.com présente un grand inventaire de telles résines et colonnes.

5.6.7 Interactions hydrophobes
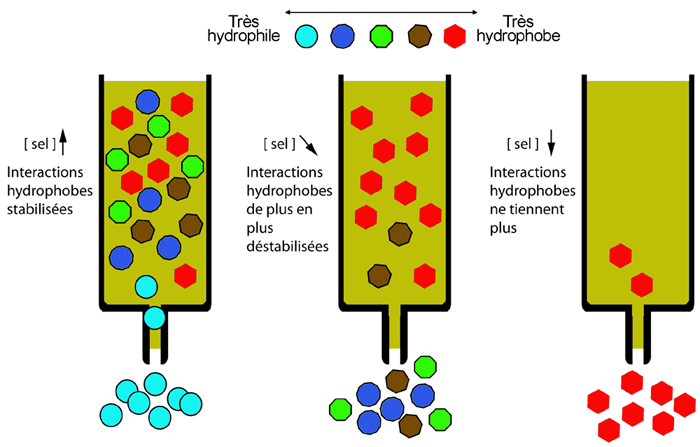
En solution, les protéines à caractère hydrophobe cherchent davantage à s'associer entre elles qu'à s'hydrater avec les molécules d'eau.
Des résines portant des groupements hydrophobiques (cycliques ou aliphatiques) permettent de retenir de telles protéines sur une colonne. À l'inverse de ce qui se passe sur une colonne de chromatographie par échange d'ions, une colonne de chromatographie d'interaction hydrophobe est chargée à haute force ionique (qui favorise les interactions hydrophobes) et est éluée avec un gradient de sel à la baisse. Grâce à cela, on peut faire passer un échantillon frais élué (avec une haute concentration en sel) d'une colonne d'échange d'ions directement sur une colonne d'interaction hydrophobe, sans avoir à dialyser ou diluer.
Les résines les plus utilisées pour ce type de chromatographie sont l'octyl- et le phényl-sépharose.
5.6.8 Hydroxyapatite
L'hydroxyapatite est du phosphate de calcium cristallisé comme nos dents en contiennent. Cette substance retient les protéines de deux façons: son calcium interagit avec les groupements acides des protéines alors que son phosphate interagit avec leurs groupements aminés. L'élution n'est pas ici faite avec un gradient de sel mais plutôt avec un gradient de phosphate ou de potassium pour compétitionner ces interactions.
| Retour à la page d'accueil | Section précédente | Section suivante |