BCM-514
Biochimie des protéines
3.0 Modifications post-traductionnelles
3.2 Ajout ou retrait de petits groupements divers:
Dans cette section, nous effectuerons un survol de plusieurs modifications qui ajoutent ou enlèvent des molécules de petites tailles aux protéines. Plus tard, nous verrons l'ajout d'acides gras et de glucides complexes.
3.2.1 acétylation
L'ajout d'un groupement acétyl- (CH3-CO- ) est une acétylation. Cette modification post-traductionnelle des protéines est dirigée par des enzymes appelés acétyltransférases. Cet ajout est réversible par un autre type d'enzyme: les déacétylases. L'acétylation se produit sur un groupement aminé, qui peut se trouver soit à l'extrémité N-terminale d'une protéine ou à l'extrémité de la chaîne latérale d'une lysine.
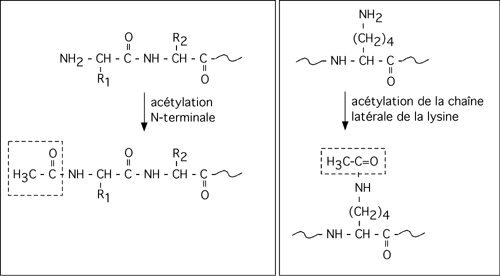
L'acétylation de plusieurs lysines localisées dans la partie N-terminale des histones H3 et H4 est impliquée dans la régulation de l'expression des gènes. Ces régions sont à l'extérieur du domaine globulaire des histones, et comme leurs nombreuses lysines chargées positivement (-NH3+ à pH neutre), elles peuvent se coller sur l'ADN qui, lui, est chargé négativement. L'acétylation des lysines neutralise leur charge positive, et les queues N-terminales n'interagissent plus avec l'ADN qui, par conséquent, est empaqueté de façon moins serrée par les histones.
Les acétyltransférases chargés d'acétyler les lysines N-terminales des histones sont recrutées par des facteurs de transcription au promoteur d'un gène -cible. Les histone déacétylases, elles, sont recrutés au promoteur d'un gène-cible par des répresseurs de la transcription. On retrouve des acétyltransférases dans le cytoplasme (comme Hat1) ainsi que dans le noyau (comme Gcn5). L'acétylation des histones dans le cytoplasme aide à l'assemblage de la chromatine (une fois qu'elles ont rejoint le noyau) et l'acétylation qui fait suite à cet assemblage a un rôle de régulation de l'expression des gènes.

|
Modifications covalentes des histones,
d'après Lee et Young (2000) Ann. Rev. Genet. 34:77-137.
Certaines lysines peuvent être soit acétylées,soit méthylées.
Ac=acétylation;
Met=Méthylation;
Ub= Ubiquitination;
P= Phosphorylation
|
Comme la combinaison de l'acétylation, de la méthylation et de la phosphorylation de certains sites a des résultats qui varient et qui ne sont pas toujours associés soit à une activation soit à une répression de la transcription, le Dr. David Allis a suggéré que ces modifications reflétaient un nouveau système de signalisation, qu'il a appelé le "code des histones". Ce code est bien entendu encore bien mystérieux, si tant est qu'il existe réellement.
Exemple de "code des histones:"
|
Histone H3
|
|
|
Pas de modification
|
répression
|
|
K14 acétylée
|
transcription
|
|
S10 acétylée + S28 phosphorylée
|
mitose
|
|
S10 phosphorylée + K14 acétylée
|
transcription
|
|
K4 méthylée
|
transcription
|
|
K9 méthylée
|
répression de la transcription
|
|
Histone H4
|
|
|
K8 acétylée + K16 acétylée
|
transcription
|
|
K5 acétylée + K12 acétylée
|
dépôt des histones
|
|
K20 méthylée
|
répression
|
Une hypothèse alternative à celle du code des histones permettrait d'expliquer le rôle de l'acétylation. En faisant un recensement du statut de l'acétylation des histones partout dans le génome de levure, le laboratoire du docteur Michael Grunstein a relevé une association significative entre certains patrons précis d'acétylation/déacétylation et la régulation commune de groupes de gènes. Ainsi, des gènes appelés à répondre à des stimuli communs pourraient voir leurs histones partager un même profil d'acétylation. Un tel profil spécifique servirait de site de reconnaissance pour des facteurs de transcription particuliers.
3.2.2 amidation
Plus de la moitié des neuropeptides actifs sont amidés en C-terminal (chez les insectes, ce chiffre atteindrait 90%). C'est le cas par exemple de l'hypocretin-1 et -2, de la galanine, ou de la calcitonine de saumon; la gastrine et la cholˇcystokinine sont ˇgalement amidˇes. L'amidation est une réaction enzymatique qui a besoin de vitamine C comme cofacteur. La source du groupement amide est une glycine placée à l'extrémité C-terminale, et chez les vertébrés cette réaction est catalysée par un enzyme bifonctionnel appelé PAM (peptidylglycine alpha-amidating monooxygenase).

3.2.3 biotinylation
La biotine est une molécule qui peut être ajoutée à la chaîne latérale de certaines lysines pour former la biocytine, le groupement actif d'enzymes telle la pyruvate carboxylase, qui carboxyle le pyruvate pour donner de l'oxaloacétate. Dans ces réactions, la biotine agit comme transporteur temporaire de groupements -COO-.

|
La biotine est une vitamine et est par définition essentielle dans la diète. L'ingestion d'une trop grande quantité de blanc d'oeuf cru peut causer une carence en biotine, car son affinité pour l'avidine, une protéine du blanc d'oeuf, est si élevée que la biotine ne peut plus être absorbée par les intestins. (En fait, l'afinité avidine-biotine a la réputation d'être la plus forte des liaisons non-covalentes connues). Une carence en biotine est mortelle.
|
3.2.4 carboxylation
La carboxylation consiste à ajouter un groupement -COOH. Elle peut se produire sur une lysine, comme dans le cas de la OXA-1 b-lactamase, sur un acide aspartique, comme cela se produit dans le facteur IX (un facteur de coagulation) ou sur un acide glutamique. Cette dernière réaction, qui donne de l'acide g-carboxyglutamique, se produit dans de nombreuses protéines impliquées dans la coagulation sanguine (Facteur II ou prothrombine, facteur VII, facteur IX, facteur X), de même que dans d'autres protéines (protéines anticoagulantes C, S et Z; ostéocalcine; certaines protéines ribosomiques).
La prothrombine, par exemple, a 10 résidus glutamates dans sa région N-terminale qui sont carboxylés.
Cette modification du glutamate semble aider les protéines à coller aux surfaces membranaires. Elle permet aussi de chélater du calcium, et celui-ci aide à former des réseaux entre les groupes glutamates et les groupements phosphates des phospholipides membranaires (pour aider à boucher les trous par où le sang s'écoule). Un pont dépendant du Ca2+ peut aussi se former entre deux groupes glutamates, une situation qui ressemble un peu à un pont disulfure.
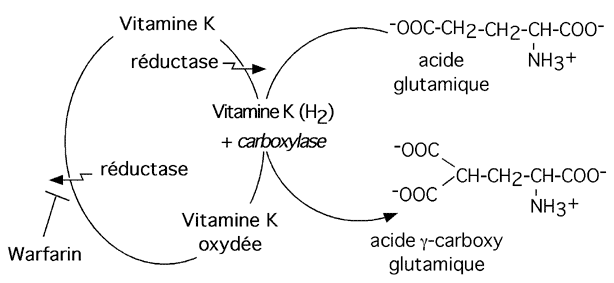
Plusieurs carboxylases ont besoin de Vitamine K comme co-facteur pour permettre la gamma-carboxylation du glutamate.
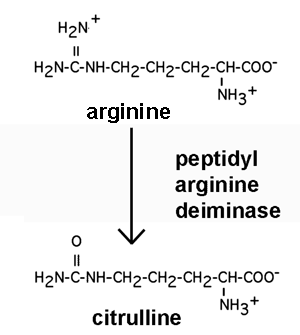
3.2.5 déimination
Certaines arginines ou méthylarginines des histones peuvent être la cible d'enzymes appelés peptidylarginine deiminases. Ces enzymes vont changer le =NH2+ de la chaîne latérale de l'arginine en =O.
Cette réaction joue probablement un rôle dans la régulation de l'expression génique passant par les modifications covalentes des histones. La transformation d'une méthylarginine, particulièrement, permettrait de jouer au niveau de la régulation épigénétique de l'expression de certains gènes: en effet, alors que jusqu'ici on avait identifié plusieurs histone méthyltransférases, on ne connaissait pas encore d'activité enzymatiques capables de renverser la méthylation des histones.
3.2.6 hydroxylation

Cette modification consiste à ajouter un groupement hydroxyl (-OH) à une protéine. On retrouve plusieurs résidus hydroxylés: les lysines et les prolines, l'acide aspartique, la tyrosine...
L'hydroxylation de la lysine et de la proline est particulièrement importante parce que ces résidus modifiés comptent pour une grande part dans la stabilité du collagène, une protéine essentielle du tissu conjonctif. L'hydroxylation de la proline par la prolyl hydroxylase, une réaction qui requiert de la vitamine C, est la réaction dont l'inhibition cause le scorbut.
3.2.7 méthylation
La méthylation consiste à ajouter un groupement -CH3 sur une lysine, une histidine, un acide aspartique ou glutamique, ou une arginine. Elle peut aussi se produire aux NH2 ou COOH terminaux. La méthylation des lysines des queues N-terminales des histones est associée à la répression de la transcription (voir le tableau en section 1.1).
3.2.8 phosphorylation
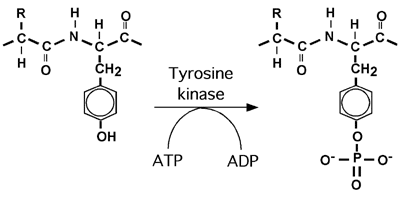
La phosphorylation est la modification la plus étudiée des protéines et joue un rôle majeur dans la signalisation cellulaire. Elle consiste en l'ajout d'un groupement phosphate sur un groupement -OH d'une protéine.
Il existe un très grand nombre de Protéines kinases (les enzymes qui ajoutent des groupements phosphates) qui appartiennent à différentes voies de signalisation. La mutliplication de ces voies permet...
(a) Une amplification de signal
(b) Une activation simultanée de plusieurs sentiers, comme dans le cas du contrôle de la dégradation du glycogène.

Les kinases ne doivent évidemment pas phosphoryler toutes les protéines contenant au moins un tyrosine, une sérine ou une thréonine, car alors aucune transmission de signal spécifique ne serait possible. Voici quelques sites-cibles de protéines-kinases:
|
Kinase
|
Séquence consensus
|
Ref.
|
| CaM II | R-X-X- S/T -X | 3,4 |
| CK I | Sp/Tp-X 2-3 -S/T -X | 2
|
| CK II | X- S/T -X-X-D/E | 1 |
| GSK3 | X- S/T -X-X-X-Sp | 3 |
| MLCK | X-K-K-R-X-X-S-X | 2,4 |
| p34cdc2 | X- S/T -P-X-R/K | 3 |
| p70s6k | K/R-X-R-X-X- S/T -X | 2 |
| PKA | R-X 1-2 -S/T -X | 3 |
| PKC | X- S/T -X-R/K | 1 |
| PKG | (R/K) 2-3 -X- S/T -X | 3 |
References:
1- PROSITE pattern.
2- Pinna, L.A. and Ruzzene M. (1996) Biochim. Biophys. Acta 1314 :191-225.
3- Kennelly, P.J. and Krebs, E.G. (1991) J. Biol. Chem. 266 :15555-15558.
4- Kemp, B.E., and Pearson, R.B. (1990) Trends Biochem. Sci. 15 :342-346.
La phosphorylation est une modification réversible, ce qui permet d'activer ou d'inactiver les voies de signalisation au besoin. La déphosphorylation est assurée par des phosphatases.
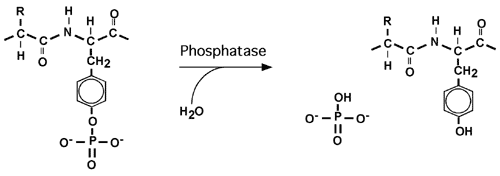
La phosphorylation réversible des protéines peut aussi jouer un rôle dans la modulation de l'activité de facteuyrs de transcription, soit en les activant directement (comme c'est le cas pour le facteur AP-1) ou en jouant sur leur localisation dans la cellule (comme c'est le cas pour les facteurs NFkB ou NFAT).
NFAT: une famille de facteurs de transcription dont l'activité est contrôlée par la déphosphorylation.

La phosphorylation du facteur NFAT le garde inactif dans le cytoplasme. Un message membranaire permet l'influx de calcium dans la cellule, ce qui stimule la phosphatase calcium-dépendante calcineurine. Celle-ci déphosphoryle NFAT qui peut migrer dans le noyau et activer la transcription de gènes cibles.
Ce système est intéressant au point de vue médical, car NFAT est impliqué dans la différentiation de cellules du système immunitaire (les lymphocytes T). Les drogues cyclosporine et FK506 sont des inhibiteurs de l'activité de la calcineurine, et par effet indirect empêchent NFAT d'aller activer les gènes requis par la réponse immune. C'est pourquoi la cyclosporine et FK506 sont utilisés comme immunosuppresseurs chez les patients porteurs d'une greffe hétérologue.
Pour en revenir au thème de la phosphorylation, notons qu'elle se produit surtout sur une tyrosine, une sérine ou une thréonine. On a aussi occasionnellement rapporté l'existence de phosphorylation d'autres résidus comme l'acide aspartique ou l'histidine. Les procaryotes n'ont que peu de gènes codant pour des sérine/thréonine kinases (entre 1 et 10). Il faut s'en souvenir quand on veut faire exprimer des protéines dans un système hétérologue: une sérine ou une thréonine se trouvant dans une protéine eucaryote qu'on fait s'exprimer dans une bactérie a peu de chances d'être phosphorylée.
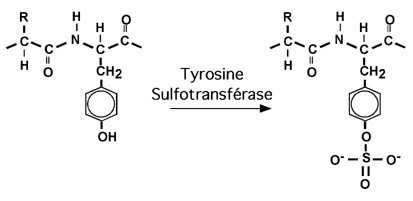
3.2.9 sulfatage (ou sulfatation)
L'ajout d'un groupement sulfate à une tyrosine se fait par une sulfotransférase. La gastrine et la cholecystokinine sont deux protéines sulfatées. Cette modification sert apparement à activer ces enzymes.
benoit.leblanc@usherbrooke.ca











