BCM-514
Biochimie des protéines
5.0 La purification des protéines
5.3 Essai (suite)
5.3.2.2.3 Electrofocalisation et gel 2D
L'électrofocalisation ou focalisation isoélectrique utilise avantageusement la charge que possède chaque protéine à un pH donné.
Elle consiste en une migration, induite par un courant électrique, des protéines dans un gradient de pH jusqu'à ce qu'elles atteignent un pH équivalent à leur pI -moment auquel elles cessent de migrer, puisque leur charge nette est nulle.
Cette technique, qui sépare les polypeptides en fonction de leur charge plutôt que de leur masse, est très sensible: elle peut distinguer des protéines dont la différence de pI est aussi faible que 0,01 unité de pH.
On génère le gradient en soumettant un mélange d'ampholytes à un courant électrique. Des tampons d'électrophorèse contenant de grandes quantités d'ampholytes sont disponibles commercialement, précisément pour utilisation en électrofocalisation.
Les ampholytes sont de petites molécules à caractère amphotère; le mélange utilisé en focalisation isoélectrique contient un très grand nombre de molécules ayant des pI différents, ce qui leur permet de se distribuer entre l'anode et la cathode et de maintenir entre elles un gradient de pH.
|
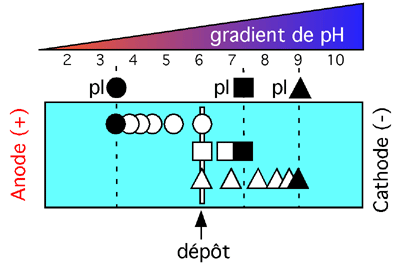
Focalisation isoélectrique.
Dans cet exemple, l'échantillon protéique est déposé dans un large puits au centre du gel. Évidemment, peu importe où l'échantillon est déposé puisque les protéines migreront dans une direction ou dans l'autre jusqu'à ce qu'elles rencontrent leur point isoélectrique, point où elles cessent de migrer.
|
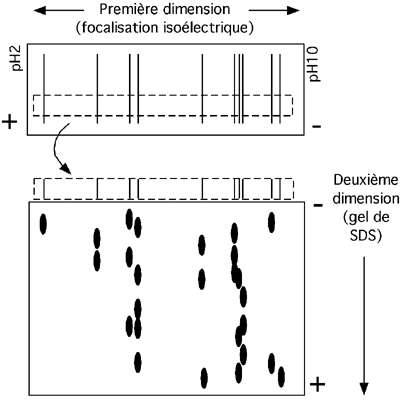
On peut combiner la séparation isoélectrique avec la séparation selon le poids moléculaire que permet le gel de SDS. Cette combinaison est appelé "gel 2D", pour deux dimensions.
|
Après l'électrofocalisation, une bande longitudinale contenant toutes les protéines séparées est coupée du gel. Cette bande ne doit pas être trop large pour que les résultats de l'étape suivante ne soient pas trop flous. Elle va servir de "puits", si l'on peut dire, pour un gel SDS, ainsi que décrit dans la figure ci-dessous.
Observez que chaque bande du gel d'électrofocalisation peut contenir plusieurs protéines de poids moléculaire différent. Si on effectuait le processus à l'envers, c'est à dire si on faisait courir un gel de SDS avant de soumettre une de ses pistes à la focalisation isoélectrique, on verrait que plusieurs protéines de même poids moléculaire ont des pI très différents.
Le gel 2D est très utilisé dans les analyses protéomiques parce qu'il sépare les protéines selon deux paramètres distincts et permet l'étude d'un plus grand nombre d'entre elles en même temps.
|
benoit.leblanc@usherbrooke.ca

