| Retour à la page d'accueil | Section précédente | Section suivante |
4.7 Cinétique enzymatique
En présence d'une certaine quantité de substrat, un enzyme va donc catalyser une réaction chimique pour donner un produit. La mesure de son efficacité est donnée par sa vitesse de réaction dans les conditions initiales de la réaction. Cette vitesse de réaction est dite "vitesse initiale" et est notée Vo.
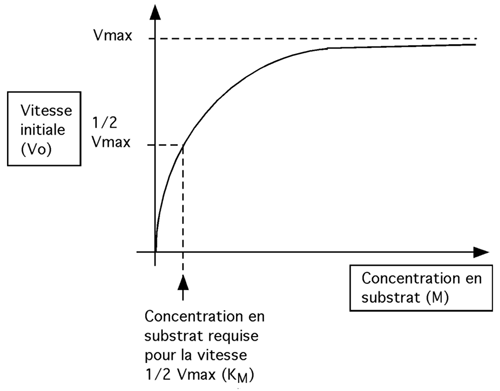
| Plus il y a de substrat, et plus l'enzyme pourra travailler vite: avec suffisamment de substrat, il devrait éventuellement atteindre une vitesse maximale (le point où son site actif est totalement saturé en substrat). Une telle vitesse est cependant une vue de l'esprit: un enzyme tend vers sa vitesse maximale en proportion directe à la quantité de substrat mais il ne l'atteind jamais. Le graphique ci-dessous montre qu'alors que l'enzyme travaille de plus en plus vite avec de faibles augmentations initiales de substrat, il parvient rapidement à un point où son rendement est tel qu'il faut énormément plus de substrat pour lui faire gagner juste un peu de vitesse supplémentaire. |

|
Il y a donc une relation entre la concentration de substrat et la vitesse de réaction d'un enzyme. Cette relation est exprimée sous forme mathématique par l'équation de Michaelis-Menten:
Vo = VMax [S] / ( KM + [S] )
où Vo est la vitesse initiale, VMax la vitesse maximale, [S] la concentration en substrat et KM une constante propre à une réaction dans des conditions données, et qui est la concentration de substrat nécessaire pour que l'enzyme atteigne (1/2) VMax (voir graphique ci-haut).
La réciproque de la réaction de Michaelis-Menten est également très utile:
1 / Vo = ( KM + [S] ) / ( VMax [S] )
qu'on peut aussi écrire
1 / Vo = Km / (VMax [S]) + [S] / (VMax [S])
et qui se simplifie en
1 / Vo = Km / (VMax[S]) + (1 / VMax)
qu'on appelle aussi équation de Lineweaver-Burke.
|
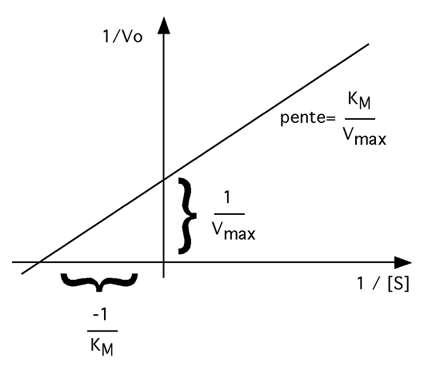
L'avantage de cette transformation mathématique est qu'elle permet de tracer un graphique 1/Vo vs 1/[S] dont la courbe est en fait une droite pour les enzymes obéissant à la relation michaélienne entre vitesse de réaction et concentration du substrat. À une concentration de substrat infinie, à laquelle la vitesse de notre enzyme serait vraiment maximale, la valeur de 1 / [S] sera de 0. Ce graphique nous permet donc de trouver facilement la valeur de 1 / Vmax, qui correspond à 1 / Vo quand l'axe des x est à zéro. |
|
Plusieurs enzymes catalysent des réactions à plus d'un substrat. L'hexokinase, par exemple, a l'ATP et le glucose comme substrats et l'ADP et le glucose-6-phosphate comme produits. Pour un tel enzyme à deux substrats, on observera un comportement dit de déplacement simple ou de déplacement double.
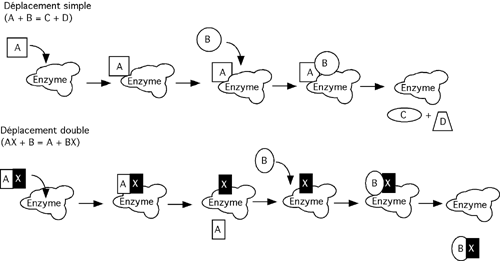
Le cas de l'hexokinase serait un déplacement double, car seul un groupement phosphate a changé de place.
4.8 Changements de conformation
Le modèle clef et serrure du substrat et de l'enzyme doit être pris avec un peu de souplesse: en effet, certaines de ces clefs ont la capacité de changer la forme de la serrure. L'hexokinas est un tel cas. Une fois que son site de reconnaissance a permis au glucose de se fixer au site actif, l'enzyme subit une profonde modification de conformation qui permet aux différentes composantes du site actif de trouver leur position appropriée dans l'espace pour catalyser le transfert d'un groupement phosphate sur le glucose. D'autre molécules peuvent entrer dans le site de reconnaissance (le ribose, le glycérol, par exemple) mais comme ils n'induisent pas un tel changement de conformation, ils ne sont pas de vrai substrats pour l'hexokinase.
Des changements de conformation peuvent être à l'origine d'une forme de régulation pour les enzymes. Prenons un enzyme possédant deux sites actifs, l'un ayant une plus forte affinité que le second pour le substrat. Après la capture d'une première molécule de substrat, le changement de conformation de l'enzyme pourrait faire en sorte que l'affinité du second site soit augmentée: il y aurait alors coopération entre les deux sites actifs. À l'inverse, il peut arriver que le second site ait une faible activité enzymatique et cause un changement de conformation nuisant au premier site; dans le cas où le substrat serait assez abondant pour que le site de faible affinité et de faible activité soit bien fourni en matériel, on assisterait à une baisse de l'activité globale de l'enzyme (c'est ce qu'on appelle une inhibition par le substrat).
Nous verrons plus loin comment les enzymes allostériques sont régulés par un changement de conformation.
| Retour à la page d'accueil | Section précédente | Section suivante |