La dégradation des protéines est une des étapes majeures de la régulation de leur activité. La dégradation peut être partielle, comme quand un zymogène est partiellement dégradé pour libérer un enzyme actif, ou totale pour complètement éliminer la molécule.
Il existe deux principaux systèmes de dégradation protéique dans la cellule: le protéasome 26S et les lysosomes.
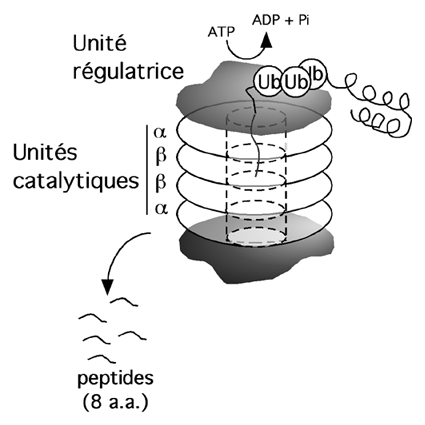
Le protéasome est un gros complexe protéique ressemblant à l'empilement de quatre anneaux, bouché à chaque extrémité par deux autres complexes protéiques. Le tunnel au centre des anneaux contient le site actif de plusieurs protéases.
L'unité régulatrice qui coiffe l'empilement reconnaît les chaînes d'ubiquitine (et donc les protéines marquées pour la destruction par ce système) et déroule la chaîne polypeptidique qu'elle fait passer dans le canal des unités catalytiques, où la chaîne est découpée en fragments d'environ huit résidus.
Les lysosomes, eux, sont des vésicules d'origine golgienne. Les enzymes lysosomiques sont glycolsylés et portent un mannose-6-phosphate, qui est reconnu à la surface interne du réticulum trans golgien par un récepteur qui dirige ces enzymes vers les lysosomes en maturation.
Les lysosomes contiennent une soupe à pH 5 contenant une grande variété d'enzyme de dégradation. Phosphatase, RNAse, DNAse, collagénase, cathepsine, peptidase, glucosidase, polysaccharidase lysozyme, hyaluronidase... tout c'qui y a de pas bon pour la santé, ce qui est normal puisque le lysosome est supposé dégrader tout ce qui y est introduit. Ces enzymes fonctionnent préférablement à pH acide, ce qui veut dire que si un lysosome vient à se briser dans la cellule ils n'iront pas tout bouffer autour d'eux (le pH du cytoplasme étant plus élevé que le pH de prédilection des enzymes lysosomaux). Il vaut quand même mieux, quand on purifie les protéines, s'assurer d'avoir un bon système tampon.
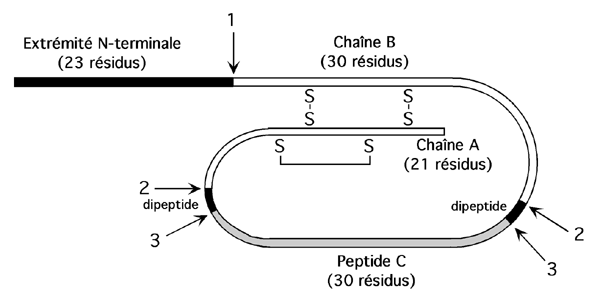
Exemple de l'insuline, activée par dégradation protéolytique à partir d'un précurseur:
Préproinsuline avec peptide signal
|
Vésicules de sécrétion des cellules B des ilôts de Langherans
(coupure du peptide signal) (1)
|
proinsuline
|
Activation par un signal cellulaire
|
Coupure du peptide C (2)
|
Insuline active, maturation du peptide C.(3)