BCM-514
Biochimie des protéines
Les acides aminés
1.0 Les acides aminés
1.1 Les vingt acides aminés de base
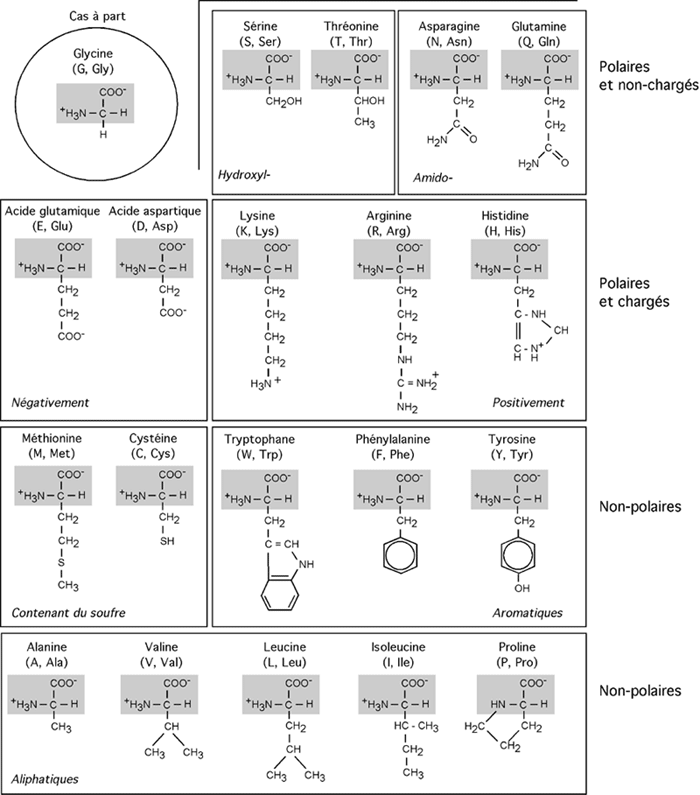
Les protéines sont de longues chaînes composées d'une succession de maillons et repliées dans l'espace. Les maillons de ces chaînes sont de petites molécules appelés acides aminés. Comme leur nom l'indique, les acides aminés portent un groupe acide (-COOH) et un groupe aminé (-NH2). Ils sont au nombre de vingt dans les protéines (nous verrons quelques exceptions à cette règle un peu plus loin). On retrouve plusieurs autres acides aminés dans l'organisme (l'ornithine, par exemple) mais ils n'entrent pas dans la composition des protéines.
Les acides aminés retrouvés dans les protéines ont tous la même structure de base: ils sont orientés autour d'un atome de carbone central, le carbone α, sur lequel s'articulent le groupe carboxyl (-COOH), le groupe aminé (-NH2), un atome d'hydrogène (-H) et un groupement latéral (noté -R). C'est la nature de ce groupement latéral (on dit aussi chaîne latérale) qui différencie les acides aminés entre eux.
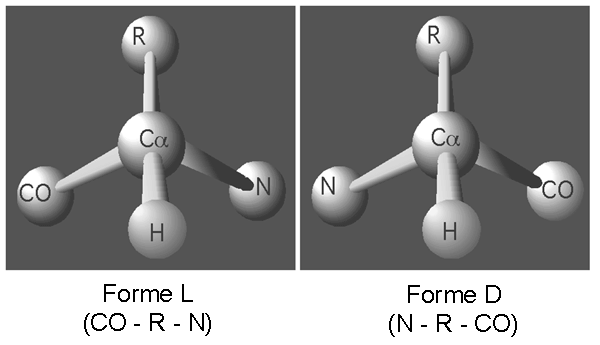
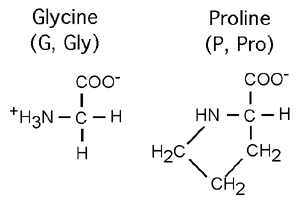
Le carbone α central est donc asymétrique dans tous les cas mis à part celui de la glycine (parce que la glycine a un hydrogène à la place d'une chaîne latérale). Cela signifie qu'il est possible d'avoir deux conformations différentes d'un même acide aminé, conformations qu'il est impossible d'interconvertir sans briser et réassembler de liens covalents. On désigne ces conformations L et D. Bien que les deux puissent être synthétisées dans une même réaction chimique, seule la forme L est utilisée dans les protéines.
|
La façon de savoir si on a affaire à une forme L ou D dans la structure d'un acide aminé est de le regarder le long de l'axe du lien qui lie son hydrogène au carbone α. Dans la forme L, l'agencement des autres groupements sur le carbone central sera le suivant dans le sens des aiguilles d'une montre: COOH, R, NH3 ou CORN. On appelle ce truc la loi de CORN.
|
|
Les chaînes latérales des acides aminés permettent de classer ces derniers en différents groupes partageant certaines caractéristiques. Certains sont polaires, et donc hydrophiles, d'autres non-polaires et donc hydrophobes. Certains sont chargés, d'autres non. Certains contiennent un cycle aromatique. Certains contiennent du soufre, etc.
|
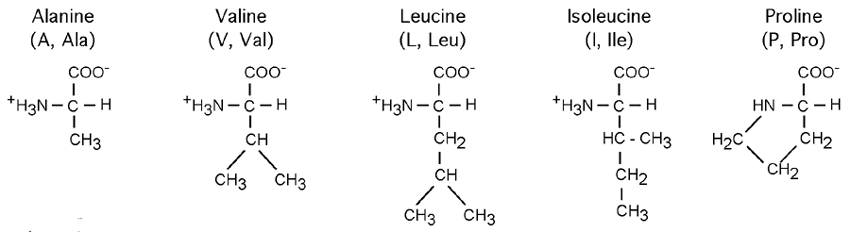
Deux acides aminés tranchent un peu parmi les autres: la glycine (G, Gly), le plus petit acide aminé, n'a en guise de chaîne latérale qu'un atome d'hydrogène. La proline (P, Pro), elle, a une chaîne latérale en forme de boucle (un anneau pyrrolidone) qui va contacter l'azote de son groupement aminé; le résultat en est que la proline est techniquement un acide iminé (-NH-) plutôt qu'aminé. L'impact de cette structure sur celle des protéines sera vu plus loin.
|
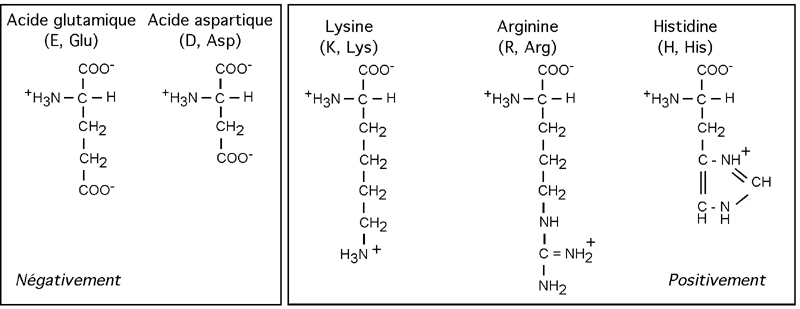
Quatre acides aminés ont une chaîne latérale fortement ionisée et donc chargée à pH neutre: il s'agit de l'acide aspartique (D, Asp) et de l'acide glutamique (E, Glu), dont la chaîne latérale porte un groupement acide supplémentaire (COOH); et de la lysine (K, Lys) et de l'arginine (R, Arg) dont la chaîne latérale porte un groupement aminé (-NH3+ pour la lysine, =NH2+ pour l'arginine). Un cinquième acide aminé, l'histidine (H, His), porte une charge positive plus faible à pH neutre.
|
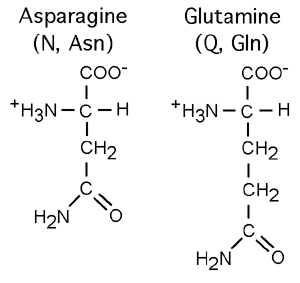
Les deux acides aminés acides ont des dérivés dont le groupement acide (-COOH) est changé pour un groupement amide (-CONH2). Il s'agit de l'asparagine (N, Asn) pour l'acide aspartique et de la glutamine (Q, Gln) pour l'acide glutamique. Ces deux acides aminés sont non-chargés à pH neutre mais restent polaires et hydrophiles.
|
|
|
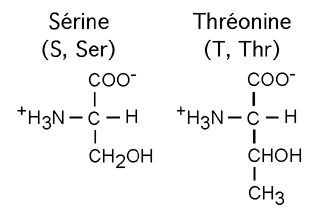
La sérine (S, Ser) et la thréonine (T, Thr) ont un groupement hydroxyl (-OH) dans leur chaîne latérale. Cela leur permet d'interagir avec l'eau et d'autres molécules en formant des ponts hydrogènes, ou d'être la cible de modifications utilisant ce site réactionnel.
|
|
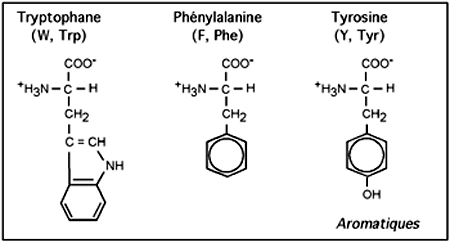
Les acides aminés contenant des cycles comme la phénylalanine (F, Phe), le tryptophane (W, Trp) ou la tyrosine (Y, Tyr) sont très hydrophobiques; c'est le cas aussi de leurs congénères dont la chaîne latérale consiste en une succession de groupements éthyl- et méthyl-. On dit de ceux-ci qu'ils sont aliphatiques. L'alanine (A, Ala), la la valine (V, Val), la leucine (L, Leu), L'isoleucine (I, Ile) sont tous des acides aminés aliphatiques.
|
|
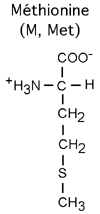
On inclut généralement dans cette famille la méthionine (M, Met), dont la chaîne latérale plutôt aliphatique contient un soufre non réactif. Notons que la tyrosine, malgré son caractère hydrophobique dû au cycle benzénique, a tout de même un groupement -OH qui, à l'instar de la sérine et de la thréonine, lui permet d'interagir avec l'eau ou d'être la cible de réaction utilisant les groupements hydroxylés.
|
|
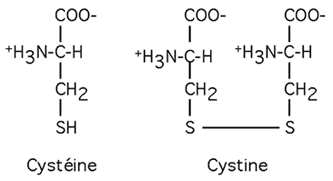
La cystéine (C, Cys) est un peu dans une classe à part, car elle a à l'extrémité de sa chaîne latérale un groupement sulfhydryl réactif.
|
Dans des conditions oxydantes, une cystéine forme fréquemment un pont disulfure avec une autre cystéine pour donner un dimère qu'on appelle cystine. Les cystéines contribuent à maintenir la structure tridimensionnelle de très nombreuses protéines grâce à cette faculté.
|
Certains acides aminés sont synthétisés à même nos cellules; d'autres doivent faire partie de notre alimentation (d'où notre besoin de manger des protéines). Ces derniers acides aminés sont dits essentiels; ce sont la thréonine, la lysine, l'histidine, l'isoleucine, la leucine, la méthionine, la phénylalanine, le tryptophane et la valine: TKHILMFWV (qu'une ritournelle mnémonique peut changer en "HoT MILK For VW"
Il faut juste se souvenir de ne pas prendre le r en considération. Le O, lui, ne code pas pour un acide aminé impliqué dans la synthèse des protéines.).
1.1.1 Les vingt acides aminés de base: quelques spécifications
|
Acide aminé
|
Code à 3 lettres
|
Code à 1 lettre
|
Poids (en g/mol)
|
mutabilité relative (a)
|
probabilité de se trouver en surface (b)
|
|
alanine
|
Ala
|
A
|
89,1
|
100
|
62
|
|
arginine
|
Arg
|
R
|
174,2
|
65
|
99
|
|
asparagine
|
Asn
|
N
|
132,1
|
134
|
88
|
|
aspartate
|
Asp
|
D
|
133,1
|
106
|
85
|
|
cystéine
|
Cys
|
C
|
121,2
|
20
|
55
|
|
glutamate
|
Glu
|
E
|
147,1
|
102
|
82
|
|
glutamine
|
Gln
|
Q
|
146,2
|
93
|
93
|
|
glycine
|
Gly
|
G
|
75,1
|
49
|
64
|
|
histidine
|
His
|
H
|
155,2
|
66
|
83
|
|
isoleucine
|
Ile
|
I
|
131,2
|
96
|
40
|
|
leucine
|
Leu
|
L
|
131,2
|
40
|
55
|
|
lysine
|
Lys
|
K
|
146,2
|
56
|
97
|
|
méthionine
|
Met
|
M
|
149,2
|
94
|
60
|
|
phénylalanine
|
Phe
|
F
|
165,2
|
41
|
50
|
|
proline
|
Pro
|
P
|
115,1
|
56
|
82
|
|
sérine
|
Ser
|
S
|
105,1
|
120
|
78
|
|
thréonine
|
Thr
|
T
|
119,1
|
97
|
77
|
|
tryptophane
|
Trp
|
W
|
204,2
|
18
|
73
|
|
tyrosine
|
Tyr
|
Y
|
181,2
|
41
|
85
|
|
valine
|
Val
|
V
|
117,1
|
74
|
46
|
(a) Probabilité qu'un résidu particulier soit muté ponctuellement pendant l'évolution. La valeur de l'alanine a été arbitrairement fixée à 100.
(b) Probabilité que 5% ou plus d'un résidu particulier se trouve à la surface d'une protéine.
Une règle informelle suggère d'utiliser un poids de 110 Daltons par résidu pour calculer à vue de nez le poids d'une protéine (même si le poids moyen d'un acide aminé est plutôt 136). Cette règle fonctionne étonnament bien dans la plupart des cas. Ainsi, le poids réel de la protéine de BARD-1, qui compte 777 acides aminés est de 86,6 kDa (poids calculé à l'aide du calculateur ScanSite du MIT, trouvé sur le site d'ExPASy) alors que le poids estimé "au pif" est de 777 acides aminés X 110 = 85,4 kDa, ce qui est très proche de la valeur réelle.
1.1.2 Autres acides aminés et autres abréviations
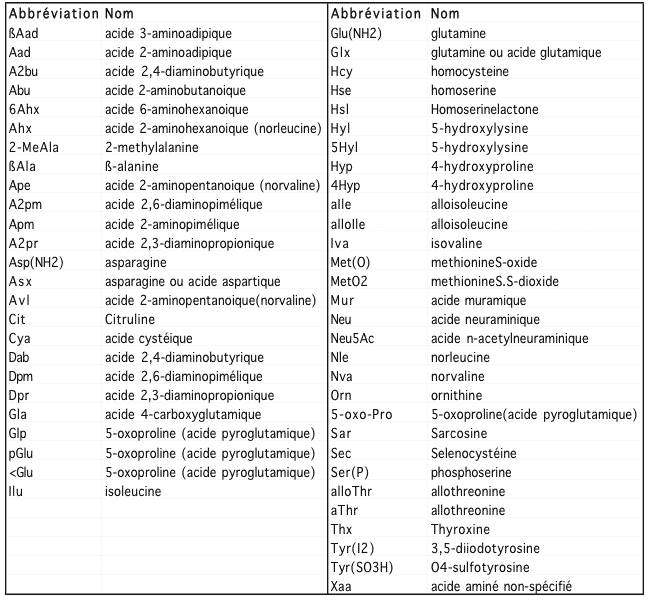
En parcourant la littérature scientifique, on tombe parfois sur des acides aminés dont le nom abrégé (Iva, Abu) n'est pas familier. Il s'agit souvent de résidus modifiés, ou parfois de noms alternatifs pour les acides aminés de base. Le tableau qui suit en désigne quelques-uns.
benoit.leblanc@usherbrooke.ca










